ARSENIC
Article modifié le
L'arsenic est l'élément chimique de symbole As et de numéro atomique 33. Bien qu'il soit très répandu dans le règne minéral et dans les organismes vivants, une quarantaine d'éléments sur quatre-vingt-douze sont plus abondants que lui ; il ne représente qu'environ cinq millionièmes en masse de la croûte terrestre. Son importance vient de son rôle physiologique ; c'est un constituant systématique de la cellule vivante, où il sert de biocatalyseur. De nombreux composés de l'arsenic sont fortement toxiques, les composés minéraux l'étant plus que les composés organiques. Néanmoins, la pharmacologie utilise de nombreux produits arsenicaux.
L'arsenic natif est rare ; à l'état naturel il existe principalement sous forme de minéraux sulfurés : le réalgar As4S4, l' orpiment As4S6 et surtout le mispickel dont la composition répond sensiblement à la formule FeAsS alors qu'il s'agit en réalité d'un mélange d'arséniure de fer FeAs2 et de pyrite FeS2 de mêmes structures cristallines ; la pyrite arsenicale FeAs2 existe également dans la nature ; à ces sulfures s'ajoutent deux oxydes, l'arsénolite et la claudétite, et de nombreux arséniates métalliques. La sublimation facile de l'arsenic élémentaire facilite sa préparation.
La belle couleur jaune d'or de l'orpiment avait attiré l'attention des Anciens : Aristote le connaissait et Pline l'appela auri pigmentum. Les alchimistes savaient griller les sulfures pour préparer l'« arsenic blanc » ou anhydride arsénieux, et il semble que l'arsenic élémentaire ait été isolé dès le xiiie siècle, mais cela reste incertain jusqu'au xviiie siècle. L'importance de l'arsenic est considérable pour les alchimistes à cause de ses relations avec le roi des métaux : l'or ; en plus de la couleur du sulfure, on savait, en effet, que l'arsenic ajouté à du cuivre donne un métal blanc qu'on assimilait à l'argent ; un pas était donc franchi d'un métal vil vers un métal noble ; il ne restait plus alors qu'à « transmuter » l'argent en or.
Propriétés
Au sein de la classification périodique des éléments, l'arsenic se situe au milieu de la cinquième colonne : il succède à l'azote et au phosphore typiquement non métalliques dont les degrés d'oxydation fondamentaux sont − III, + III et + V ; il précède l' antimoine et le bismuth chez lesquels le caractère métallique s'accentue avec prépondérance presque exclusive du degré d'oxydation + III. L'arsenic est un élément intermédiaire qui se rattache tantôt à un groupe, tantôt à l'autre. Comme l'azote et le phosphore, l'arsenic possède un hydrure AsH3, assez stable, qui est à l'origine d'une importante famille de dérivés organiques. Le phosphore et l'arsenic ont des électronégativités très voisines. Pour ces deux éléments, les composés oxygénés pentavalents sont les plus stables. L'arsenic se rapproche de l'antimoine et du bismuth par sa structure cristalline et par le fait que la variété stable conduit la chaleur et l'électricité. Son caractère métallique apparaît aussi dans les arséniures métalliques, qui ont souvent les propriétés d'un alliage.
Cortège électronique, modes de liaison
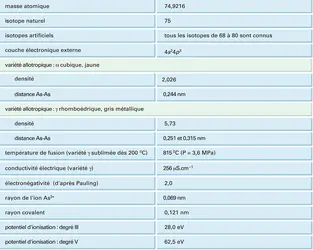
Le cortège électronique de l'arsenic se compose de deux électrons K, huit électrons L et dix-huit électrons M, qui constituent le cœur chimiquement inerte de l'atome. La couche de valence possède cinq électrons, répartis en un doublet 4s et trois électrons non appariés, chacun sur une orbitale 4p (cf. tableau).
Ce cortège électronique offre plusieurs possibilités théoriques de liaison avec d'autres atomes, ce qui implique des propriétés structurales différentes. Il faut remarquer que, même dans les arséniures alcalins comme Na3As, l'ion As3- n'existe pas, ce qui fait ressortir le caractère métallique de l'arsenic. La structure des composés tricoordonnés de l'arsenic peut s'expliquer de deux façons. On peut imaginer une hybridation faisant intervenir l'orbitale s et les trois orbitales p ; l'atome possède alors quatre orbitales équivalentes notées sp3 et qui pointent vers les quatre sommets d'un tétraèdre centré sur l'atome d'arsenic ; trois de ces orbitales sont occupées par un doublet de liaison et la quatrième possède une paire électronique non liante. Un autre schéma peut être proposé dans lequel les électrons 4s n'interviennent pas et constituent une paire inerte, la liaison étant assurée par les trois orbitales p pures, non hybridées et dont les directions font entre elles des angles de 900. De nombreux faits expérimentaux montrent que la première hypothèse correspond davantage à la réalité dans presque tous les composés de l'arsenic. Il semble que seuls les anions exceptionnels (AsCl4)- ou (AsBr4)- possèdent une paire inerte. La structure tétraédrale est certaine dans le cas de la molécule As4, des oxydes et des sulfures d'arsenic.
Dans les composés pentavalents, un autre mode de liaison, qui fait intervenir les orbitales d vacantes, a pu être mis en évidence. La structure est alors trigonale, bipyramidale comme dans AsF5, qui possède trois atomes de fluor aux sommets d'un triangle équilatéral dont le centre est occupé par l'atome d'arsenic, les deux atomes de fluor restants se trouvant de part et d'autre du plan déterminé par les autres atomes. L'intervention des orbitales d justifie également la structure octaédrique de l'arsenihexafluorure de potassium K (AsF6).
Variétés allotropiques
L' arsenic présente trois variétés allotropiques cristallines ; deux sont bien définies, la troisième n'est pas caractérisée avec certitude. Par refroidissement brutal (trempe) de la vapeur, on obtient la variété α ou arsenic jaune, semblable au phosphore blanc ; les molécules As4 qui la composent ont la géométrie d'un trétraèdre régulier. L'arsenic α est soluble dans le sulfure de carbone, la solution étant constituée également de molécules As4. Cette variété est toujours métastable et se transforme en arsenic gris ou γ sous l'action du brome et de l'iode, ou lorsqu'on l'expose à la lumière, même à la température de l'air liquide. L'arsenic gris est stable et insoluble dans le sulfure de carbone ; sa structure est semblable à celle de l'antimoine et du bismuth ; elle est constituée de feuillets où chaque atome possède trois plus proches voisins situés dans le même feuillet à 0,251 nm et trois voisins plus éloignés dans le feuillet suivant à 0,315 nm. Par sublimation d'arsenic gris dans un courant d'hydrogène, on obtient l'arsenic noir mal défini, insoluble dans le sulfure de carbone et qui redonne l'arsenic γ dès 350 0C.
Les molécules As4 sont stables en phase vapeur jusqu'à 800 0C ; au-delà, elles se dissocient en molécules As2, puis en atomes à partir de 1 700 0C. Le passage à l'état gazeux se fait par sublimation ; l'arsenic liquide n'a pu être obtenu que sous pression.
La réactivité chimique de l'arsenic varie beaucoup selon son état cristallin ; l'arsenic α s'oxyde à l'air dès la température ambiante, comme le phosphore blanc, alors que la variété noire résiste jusque vers 80 0C et que l'arsenic gris doit être chauffé à 250 0C pour réagir avec l'oxygène. Cette dernière variété est celle que l'on considère dans l'exposé des propriétés chimiques de l'élément.
L'arsenic s'enflamme spontanément dans le fluor, le chlore et le brome avec formation de trihalogénures ; le triiodure se forme à chaud. Le carbone, l'azote et l'hydrogène ne donnent pas de réaction directe, et les acides non oxydants n'agissent pas. L'acide nitrique, selon sa concentration, conduit à des solutions d'arsenic tri- ou pentavalent, et les bases alcalines fondues provoquent la formation d'arsénites avec dégagement d'hydrogène.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean PERROTEY : docteur ès sciences, maître assistant à l'université de Haute-Normandie
Classification
Médias
Autres références
-
ARSENIC, toxicologie
- Écrit par Encyclopædia Universalis
- 255 mots
L'arsenic entrait autrefois dans la composition de nombreux produits insecticides, raticides, pesticides comme de certaines peintures, papiers peints et céramiques.
L'empoisonnement arsenical chez l'homme résulte souvent de l'ingestion ou de l'inhalation d'un insecticide contenant oxyde arsénieux,...
-
ANTIMOINE
- Écrit par Encyclopædia Universalis et Jean PERROTEY
- 3 876 mots
- 3 médias
...essentiellement par des dérivés organiques, tandis que les composés + III sont les plus nombreux et que la stabilité du degré + V est plus faible que chez l'arsenic. Par l'ensemble de ses propriétés, l'antimoine est très proche de l'arsenic, avec un caractère métallique plus accentué. Le potentiel électrochimique de... -
LÖLLINGITE
- Écrit par Yannick LOZAC'H
- 306 mots
-
MATIÈRE (physique) - État solide
- Écrit par Daniel CALÉCKI
- 8 631 mots
- 12 médias
L'atome d'arsenic possède cinq électrons de valence et trois places vacantes sur sa couche externe. Dans un cristal d'arsenic, chaque atome établit trois liaisons covalentes avec trois atomes premiers voisins. Ces liaisons forment un trièdre, l'angle entre deux liaisons étant égal à 92,8... -
OLIGOÉLÉMENTS
- Écrit par Jean LAVOLLAY
- 3 577 mots
- 1 média
- Afficher les 9 références
Voir aussi