COMBUSTION
Article modifié le
Aspect énergétique de la combustion
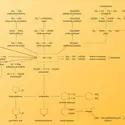
Les réactions chimiques à l'origine des flammes sont toutes exothermiques. Il y a donc lieu de mesurer la chaleur dégagée par des quantités de combustible mesurées avec précision. La chaleur de combustion d'un composé chimique est la quantité de chaleur dégagée par la combustion d'une mole de ce composé à la température de référence choisie (de 0 à 25 0C). Elle est égale à la diminution d'enthalpie :

Au point de vue des applications, on a intérêt à se référer non plus à la mole mais au kilogramme de combustible pour les liquides et les solides, et au mètre cube pour les gaz.
Le pouvoir calorifique d'un solide ou d'un liquide est sa chaleur de combustion rapportée à l'unité de masse :

Le pouvoir calorifique volumétrique Pcv est le pouvoir calorifique rapporté au litre de combustible ; il est surtout utilisé en aviation :



La différence entre les pouvoirs calorifiques à pression constante et ceux à volume constant est très faible, et négligeable en première approximation (de l'ordre de 0,1 à 0,2 p. 100).
Le pouvoir calorifique dépend évidemment de l'état physique du combustible et des produits de la combustion. Le pouvoir calorifique supérieur correspond à une mesure faite après condensation de l'eau. Le pouvoir calorifique inférieur correspond à une mesure faite alors que la vapeur d'eau n'est pas condensée. Pour passer de l'un à l'autre, il faut donc tenir compte de l'enthalpie de vaporisation de l'eau :

La mesure du pouvoir calorifique se fait dans la « bombe » à oxygène, elle-même située à l'intérieur d'un calorimètre. Cette méthode est valable pour les solides et les liquides. Elle permet de mesurer la chaleur dégagée par une quantité déterminée de matière.
Pour les gaz, on utilise un calorimètre du type Junkers. La chaleur que dégage la flamme d'un brûleur alimenté par le gaz dont le pouvoir calorifique doit être mesuré est cédée à un courant d'eau à débit constant dont on mesure l'élévation de température. D'après le principe de conservation de l'énergie, on a :

Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Michel LUCQUIN : ingénieur diplômé de l'École nationale supérieure de chimie de Paris, professeur à l'université des sciences et techniques de Lille
Classification
Médias
Autres références
-
ACÉTYLÈNE
- Écrit par Henri GUÉRIN
- 5 094 mots
- 6 médias
...endothermique (ΔH = 226,5 kJ/mole) est instable ; cela explique la facilité avec laquelle il donne lieu à des réactions de synthèse et sa grande chaleur de combustion (58 000 kJ/m3) :et aussi les risques d'explosions, dès qu'il est en présence d'air ou même en l'absence de celui-ci, lorsqu'on le comprime....
-
ALCANES
- Écrit par Jacques METZGER
- 3 616 mots
- 11 médias
La combustion des alcanes à l'air est une réaction fortement exothermique (réaction 4) qui est abondamment exploitée pour la production de chaleur (chauffage industriel et domestique) et d'énergie mécanique (moteurs à combustion interne, réacteurs). La chaleur de combustion des alcanes à ... -
AUTOMOBILE - Technologie
- Écrit par Georges BRESSON , Jean-Pierre CAPET , François de CHARENTENAY , Encyclopædia Universalis , Thierry HALCONRUY , Frédéric RIVAS et Jean-Pierre VÉROLLET
- 15 882 mots
- 27 médias
Le succès de l'automobile a été assuré, et le demeure pour quelques décennies encore, par l'efficacité dumoteur thermique dit à combustion interne (cycle 4 temps) qui équipe plus de 98 p. 100 des voitures. Ce type de moteur transforme l'énergie chimique des carburants en énergie... -
BALISTIQUE
- Écrit par Jean GARNIER
- 2 102 mots
- 2 médias
...ou le mélange des trois. Cependant, en raison des difficultés de stockage, les propergols les plus employés sont solides ou liquides. Le contrôle de la combustion des propergols liquides s'effectue au moyen de mécanismes auxiliaires qui règlent la quantité de carburant admise dans la chambre de combustion.... - Afficher les 26 références
Voir aussi
- STŒCHIOMÉTRIE
- ONDE DE CHOC
- PRESSION, physique
- LIQUIDE ÉTAT
- ÉMISSION, physique
- CALORIFIQUE POUVOIR
- COMBUSTIBLES
- COMBURANTS
- VAPORISATION
- PLASMAS
- CALORIMÈTRE, thermique
- EXPLOSION
- GAZÉIFICATION
- INFLAMMATION, technologie
- OXYDATION
- DÉFLAGRATION
- DÉTONATION
- EXOTHERMIQUE RÉACTION
- EXTINCTEURS
- TEMPÉRATURE
- SOLIDES PHYSIQUE DES
- HYDROGÈNE CHALUMEAU À
- FLAMME
- BUNSEN BEC
- JUNKERS CALORIMÈTRE DE
- POUSSIÈRES
- CHALUMEAUX
- COUP DE POUSSIÈRES