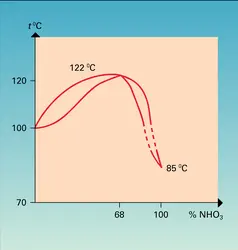
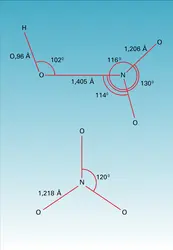
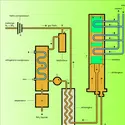
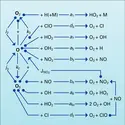
NITRIQUE ACIDE
Article modifié le
Bibliographie
F. A. Cotton et al., Advanced Inorganic Chemistry, 6e éd., Wiley, New York, 1999
P. J. & B. Durrant, Introduction to Advanced Inorganic Chemistry, 2e éd., ibid., 1970
E. Martin & J. Quibel, « Acide nitrique : historique des procédés de fabrication », in Génie des procédés, J 6020-323, coll. Techniques de l'ingénieur, Paris, 1983
P. Pascal, « Azote », in P. Pascal dir., Nouveau Traité de chimie minérale, t. X, Masson, Paris, 1968.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean ROUXEL : professeur à l'université de Nantes
Classification
Médias
Autres références
-
AMMONIAC
- Écrit par Henri GUÉRIN
- 5 035 mots
- 5 médias
En présence d'une toile de platine portée à 700-800 0C l'azote passe au degré + 2 en formant du monoxyde d'azote (oxyde azotique). C'est la réaction de base de la synthèse de l'acide nitrique :
-
ATMOSPHÈRE - Chimie
- Écrit par Marcel NICOLET
- 3 554 mots
- 5 médias
La concentration de NO et de NO2 dans la stratosphère résultant d'une production continuelle à partir de N2O (équation 13a) est cependant limitée par d'autres réactions. Nous retiendrons surtout celle qui donne lieu à la formation de l' acide nitrique par le mécanisme :
-
CYCLES BIOGÉOCHIMIQUES
- Écrit par Jean-Claude DUPLESSY
- 7 882 mots
- 6 médias
– L' acide nitrique, HNO3, résulte de l'oxydation naturelle des oxydes d'azote. Il est produit industriellement, car les nitrates servent à fabriquer des engrais et des explosifs. -
EAU RÉGALE
- Écrit par Dina SURDIN
- 223 mots
Mélange de deux ou trois volumes d'acide chlorhydrique concentré et d'un volume d'acide nitrique concentré. Les alchimistes ont appelé ce mélange « eau régale » (c'est-à-dire royale) pour ses propriétés : il dissout en effet l'or et d'autres métaux dits nobles....
- Afficher les 8 références
Voir aussi