ACIDES-ALCOOLS
Article modifié le
Un acide-alcool est une molécule renfermant au moins une fonction acide carboxylique et une fonction alcool.
La nature nous en fournit de nombreux exemples : acides lactique du lait aigri, malique des pommes avant maturité (diacide-monoalcool), tartrique du tartre des vins (diacide-diacool), citrique du citron (triacide-monoalcool), etc. Ces derniers, d'une saveur aigrelette agréable interviennent dans la fabrication de produits alimentaires.
Cristallisant facilement, ils comptent parmi les premiers composés organiques isolés et étudiés. Leur nomenclature officielle résulte de celle des acides carboxyliques (alcanoïque), à laquelle on ajoute le suffixe -ol suivi de la position occupée par la fonction alcool sur la chaîne. Une nomenclature courante les désigne comme acide α-, β-, γ-...alcool. L'acide lactique CH3−CHOH−COOH est appelé propanol-2-oïque ; c'est un acide α-alcool.
Modes d'obtention
Les modes d'obtention se distinguent par la position relative des deux fonctions.
Les acides α-alcools sont obtenus par trois voies principales :
– oxydation nitrique ménagée d'un α-glycol : l'éthylène glycol est ainsi transformé en acide glycolique ou éthanol-2-oïque ;
– hydrolyse d'un acide α-halogéné : l'acide lactique est obtenu par hydrolyse alcaline de l'acide α-chloropropionique ;
– hydrolyse d'un nitrile α-alcool appelé cyanhydrine α résultant de l'addition, sur un aldéhyde, de l'acide cyanhydrique.
Les acides β-alcools sont préparés par trois méthodes principales :
– hydratation, en milieu alcalin, des acides α-éthyléniques ;
– hydrolyse d'un nitrile β-alcool appelé cyanhydrine β, résultant de l'addition, sur un époxyde, de l'acide cyanhydrique ou de la substitution par l'ion cyanure du chlore d'une chlorhydrine α : l'acide hydracrylique (hydroxy-3-propanoïque) est préparé par hydrolyse de l'éthylènecyanhydrine obtenue par cyanuration de la chlorhydrine du glycol ;
– hydrolyse des esters β-alcools obtenus par condensation d'un ester α-halogéné sur un aldéhyde ou une cétone en présence de zinc ; c'est la réaction de Réformatsky.
On peut également les obtenir par l'hydrogénation catalytique des acides β-cétoniques
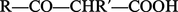
Les acides γ-et δ-alcools n'existent comme tels qu'en solution aqueuse très diluée ou sous forme de sels alcalins, sinon ils se déshydratent spontanément en formant un ester interne cyclique appelé γ- ou δ-lactone. Leur préparation, comme celle des lactones dont ils résultent par hydrolyse, peut-être réalisée par quatre voies principales :
– hydrolyse alcaline des acides γ- ou δ-halogénés ;
– cyclisation, en catalyse acide, des acides γ- ou δ-éthyléniques : c'est l'estérification intramoléculaire d'un acide carboxylique par un alcène ;
– hydrogénation ménagée des anhydrides cycliques de γ- ou δ-diacides par l'amalgame de sodium ou le zinc et l'acide acétique : réduction de l'anhydride glutarique en valérolactone ;
– oxydation de Baeyer-Villiger des cétones cycliques : préparation de la pentadécalactone ou exaltolide par oxydation à l'acide peroxosulfurique ou acide de Caro de la cyclopentadécanone.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Média
Voir aussi


