CARBOXYLIQUES ACIDES
État naturel et préparations
Les corps gras d'origine animale et végétale sont, en très grande majorité, constitués par des esters d'un trialcool, le glycérol, et d'acides linéaires à nombre pair d'atomes de carbone, éventuellement insaturés ou porteurs d'une fonction alcool, appelés acides gras (glycérides). Les cires, animales et végétales (cérides), sont des esters d'acides gras et d'alcools à longue chaîne : le blanc de baleine ou palmitate de cétyle est l' ester de l'acide palmitique C15H31CO2H et de l'alcool cétylique C15H31CH2OH (hexadécanol), tandis que la cire de Carnauba renferme en particulier du palmitate de myricyle (C15H31CO2C30H61). Les stérides, esters d'acides gras et d'alcools particuliers appelés stérols, sont également présents à l'état naturel : la lanoline, extraite de la graisse de suint de mouton qui est un ester de lanostérol (un alcool tétracyclique en C30), les stérides du plasma sanguin.
Qu'elles soient industrielles ou de laboratoire, les principales méthodes de préparation des acides carboxyliques peuvent être classées en deux familles, selon que la chaîne carbonée du substrat de départ est conservée ou modifiée.
Réactions de préparation sans modification de la chaîne carbonée
Hydrolyse
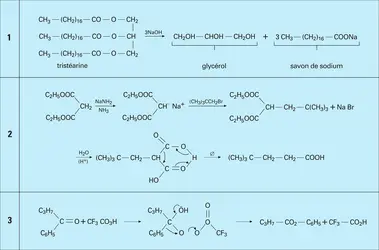
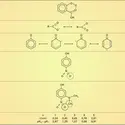
Les réactions d'hydrolyse des esters naturels, notamment des triglycérides provenant des graisses animales, sont réalisées en présence de soude et donnent, outre le glycérol, un mélange de sels de sodium des acides palmitique, stéarique et oléique. Ce savon de sodium peut être hydrolysé en milieu acide (H2SO4) et fournit les acides eux-mêmes (réaction 1).
L'hydrolyse des fonctions trivalentes, obtenues par synthèse, donne également accès aux acides carboxyliques. Les nitriles en particulier, facilement accessibles par action du cyanure de potassium sur les halogénures ou les tosylates d'alkyle, sont hydrolysés en catalyse acide ou basique. Les dérivés trichlorométhylés des aromatiques, résultant de la chloration photochimique des dérivés méthylés correspondants, sont hydrolysés en catalyse acide en acides carboxyliques.
Oxydation
L' oxydation des alcools primaires en aldéhydes puis en acides est réalisée, au laboratoire, sous l'action d'oxydants énergiques comme KMnO4 ou K2Cr2O7 en milieu acide (cf. alcools ; aldéhydes et cétones). L'une des préparations industrielles de l'acide acétique concerne l'oxydation, par l'air, de l'acétaldéhyde, avec catalyseur au cobalt, à température ordinaire et sous faible pression.
Les cétones cycliques sont oxydées, avec ouverture de la chaîne, en diacides : c'est l'un des procédés d'obtention de l'acide adipique par oxydation de la cyclohexanone (cf. aldéhydes et cétones).
Enfin, les hydrocarbures aromatiques méthylés, notamment le toluène, peuvent être oxydés par l'air, en présence de catalyseurs au cobalt, en acides arylcarboxyliques.
Réactions de préparation avec augmentation de la chaîne carbonée
Carboxylation d'organométalliques
Un procédé très général de synthèse des acides carboxyliques est l'addition des organomagnésiens sur l'anhydride carbonique. D'autres dérivés de l'acide carbonique peuvent être utilisés, notamment le chloroformiate et le carbonate d'éthyle, qui conduisent à l'ester éthylique de l'acide à un carbone de plus.
La synthèse malonique est également une méthode très générale pour introduire, sur une chaîne alkyle ou aryle, un groupement —CH2CO2H. Le malonate d'éthyle est transformé en carbanion par une base forte comme l'éthylate, ou, mieux, l'amidure de sodium. L' halogénure d'alkyle ou d'aryle est condensé sur ce carbanion et conduit à l'alkyl- ou aryl-malonate d'éthyle. Par hydrolyse acide, on passe à l'acide malonique substitué qui, comme tous les[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Médias
Autres références
-
ACÉTIQUE ACIDE
- Écrit par Jacques METZGER
- 2 113 mots
- 3 médias
L'acide acétique, acide organique de formule CH3COOH, est le membre le plus important de la famille des acides carboxyliques. Il joue avec ses dérivés un rôle essentiel dans de nombreuses synthèses et dégradations biologiques accompagnant le métabolisme des aliments et la formation des tissus....
-
ACÉTYLACÉTIQUE ESTER
- Écrit par Jacques METZGER
- 1 356 mots
- 2 médias
L'acide acétylacétique est le nom usuel du butanone-3-oïque :

Cet acide a été isolé dans les urines pathologiques. Il peut être obtenu par une hydrolyse prudente de son ester éthylique. Ce dernier, beaucoup plus important, est un intermédiaire utilisé dans l'industrie pharmaceutique et dans...
-
ACIDES-ALCOOLS
- Écrit par Jacques METZGER
- 1 300 mots
- 1 média
Un acide-alcool est une molécule renfermant au moins une fonction acide carboxylique et une fonction alcool.
La nature nous en fournit de nombreux exemples : acides lactique du lait aigri, malique des pommes avant maturité (diacide-monoalcool), tartrique du tartre des vins (diacide-diacool), citrique...
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 367 mots
- 7 médias
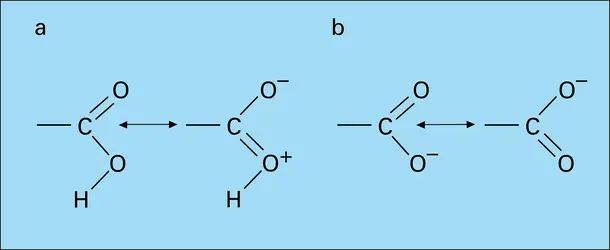
Un acide carboxylique s'ionise en un anion mésomère (formule 2), si bien qu'en fait la charge négative est répartie entre les deux atomes d'oxygène, donnant une structure intermédiaire entre les précédentes (on dit qu'il y a résonance entre celles-ci). La structure réelle... - Afficher les 15 références