CARBOXYLIQUES ACIDES
Propriétés chimiques
Les propriétés chimiques des acides carboxyliques peuvent être rattachées à quatre schémas : la coupure hétérolytique de la liaison O—H, la substitution nucléophile du groupe OH, la réactivité de la chaîne carbonée, induite, notamment en α, par le groupe fonctionnel et les décarboxylations.
Réactions de la coupure O—H
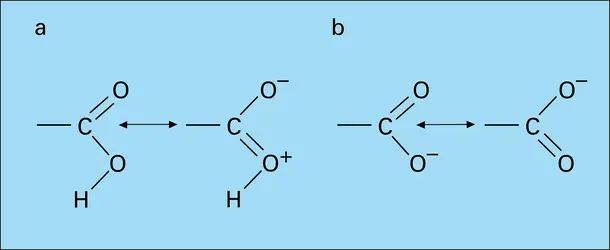
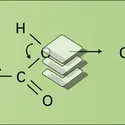
La structure électronique de la fonction carboxylique (fig. 1a) laisse prévoir une importante polarisation de la liaison O—H, tant par le jeu des électronégativités que par la conjugaison interne du système. L' hétérolyse de cette liaison conduit d'autre part à un anion carboxylate, dont la structure symétrique (fig. 1b) est responsable de la grande stabilité. Les acides carboxyliques présentent en effet, en solution aqueuse, une dissociation qui les classe parmi les acides, faibles il est vrai :
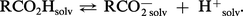
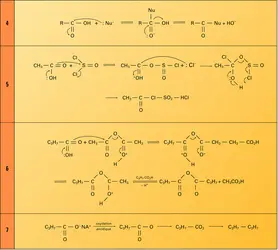
Les sels alcalins, formés par action des bases, sont solubles, pour les premiers termes. Ils sont thermiquement très stables ; l'acétate de sodium anhydre fond sans décomposition à 450 0C. Les sels alcalino-terreux, également solubles pour les premiers termes, sont thermiquement moins stables : vers 300 0C, ils se décomposent en carbonate alcalino-terreux et cétones (cf. aldéhydes et cétones). Les sels d'ammonium, chauffés, se déshydratent, réversiblement, en amides, puis en nitriles.
L'hétérolyse de la liaison O—H se produit également lors de l'addition des acides carboxyliques sur les alcènes en présence de catalyseur acide avec formation d'un ester :
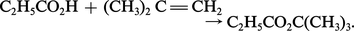
Il en est de même lors de l'estérification des acides par la diazométhane, une méthode douce et spécifique d'obtention des esters méthyliques.
Réactions de substitution nucléophile du groupe OH
Ces réactions de remplacement du groupe OH par un autre nucléophile conduisent aux dérivés de la fonction acide : chlorure d'acide, anhydride, ester, amide. Elles font intervenir, en fait, une addition sur le groupe carbonyle suivie d'une élimination du groupe OH (réaction 4) ; ce dernier étant un mauvais groupe partant (HO– est en effet basique), il est souvent transformé, au cours de la réaction, en meilleur groupe partant.
Formation d'un chlorure d'acide. Opposé à un chlorure d'acide minéral comme PCl3 ou mieux SOCl2, l'acide réagit dans un premier temps en formant un anhydride mixte qui possède un meilleur groupe partant que l'acide de départ. L'ion chlorure attaque cet intermédiaire dans un processus d'addition nucléophile, suivi de l'élimination de molécules neutres (réaction 5).
Formation d'un anhydride d'acide. Le nucléophile, dans ce cas, est l'acide lui-même et il faut le modifier pour améliorer son groupe partant ; de nombreux réactifs permettent cette modification, notamment des anhydrides d'acides minéraux (P4O10) ou organique (anhydride acétique en catalyse acide). Comme dans le cas précédent, l'acide substrat réagit, dans un premier temps, en formant avec l'anhydride réactif, activé par le catalyseur acide, un anhydride mixte ; une seconde molécule d'acide, jouant le rôle de nucléophile, attaque ce dernier pour former un second anhydride mixte et l'opération se renouvelle une troisième fois avec formation de l'anhydride symétrique. L'ensemble étant réversible, on déplace l'équilibre vers la formation de l'anhydride symétrique en distillant l'acide acétique au fur et à mesure de sa formation (réaction 6).[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Médias
Autres références
-
ACÉTIQUE ACIDE
- Écrit par Jacques METZGER
- 2 113 mots
- 3 médias
L'acide acétique, acide organique de formule CH3COOH, est le membre le plus important de la famille des acides carboxyliques. Il joue avec ses dérivés un rôle essentiel dans de nombreuses synthèses et dégradations biologiques accompagnant le métabolisme des aliments et la formation des tissus....
-
ACÉTYLACÉTIQUE ESTER
- Écrit par Jacques METZGER
- 1 356 mots
- 2 médias
L'acide acétylacétique est le nom usuel du butanone-3-oïque :

Cet acide a été isolé dans les urines pathologiques. Il peut être obtenu par une hydrolyse prudente de son ester éthylique. Ce dernier, beaucoup plus important, est un intermédiaire utilisé dans l'industrie pharmaceutique et dans...
-
ACIDES-ALCOOLS
- Écrit par Jacques METZGER
- 1 300 mots
- 1 média
Un acide-alcool est une molécule renfermant au moins une fonction acide carboxylique et une fonction alcool.
La nature nous en fournit de nombreux exemples : acides lactique du lait aigri, malique des pommes avant maturité (diacide-monoalcool), tartrique du tartre des vins (diacide-diacool), citrique...
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 367 mots
- 7 médias
Un acide carboxylique s'ionise en un anion mésomère (formule 2), si bien qu'en fait la charge négative est répartie entre les deux atomes d'oxygène, donnant une structure intermédiaire entre les précédentes (on dit qu'il y a résonance entre celles-ci). La structure réelle... - Afficher les 15 références