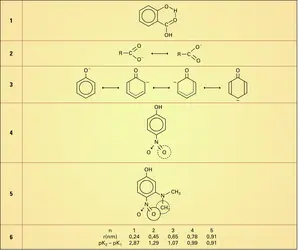
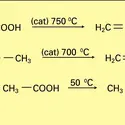
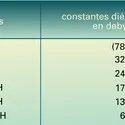
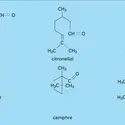
ACIDES & BASES
Article modifié le
Premières théories
On invoqua d'abord des causes occultes pour expliquer les propriétés particulières des acides et des bases. Paracelse (début du xvie s.) croyait à un acide élémentaire universel, communiquant à tous ses composés la saveur et le pouvoir dissolvant, et, plus tard, Glauber (début du xviie s.) reconnut la notion de « force relative des acides », définie par la possibilité de déplacement d'un acide par un autre. Stahl pensa que ce « principe universel » était l'acide sulfurique, le plus puissant qui fût connu à son époque ; d'autres, après lui, firent jouer ce rôle à l'acide phosphorique, non volatil. Boerhaave, au contraire, attribuait ces différences de force à une dilution par l'eau, plus ou moins marquée.
Une configuration géométrique des acides avait été proposée, dès 1667, par un médecin, André ; il imaginait leurs particules pourvues de petites aiguilles très fines, d'où leur action sur l'organe du goût ; les bases, au contraire, renfermaient de petits pores, dont le remplissage par les pointes des acides constituait la neutralisation.
Ce fut Lavoisier qui, le premier, tenta d'établir une corrélation entre les manifestations de l'acidité et la composition chimique des substances. S'appuyant sur le fait que la combustion de nombreux éléments (carbone, soufre, phosphore) dans l'oxygène conduit à des oxydes formant un acide avec l'eau (quoique celle de l'hydrogène le déçoive), il conclut (1785) que l'oxygène est nécessaire à la manifestation de l'acidité. Cependant, dès 1787, Berthollet montrait que l'acide « prussique » (cyanhydrique) ne contient que les éléments carbone, azote, hydrogène, et que vraisemblablement l'acide sulfhydrique ne doit contenir que du soufre et de l'hydrogène. Mais l'empreinte de Lavoisier fut telle qu'il fallut des constatations nouvelles pour infirmer l'hypothèse primitive. En 1811, Davy prouva que l'acide « muriatique » (chlorhydrique) ne contenait pas d'oxygène (même constatation en 1815 pour l'acide iodhydrique), concluant ainsi que l'acidité n'est reliée à la présence d'aucun élément particulier. Ce dernier point ne s'est pas révélé exact, et Dulong puis Liebig (1838) revinrent à la notion d'un même élément présent dans tous les acides ; néanmoins cet élément est non pas l'oxygène, mais l'hydrogène ; ces conceptions continuèrent à être adoptées pendant environ cinquante ans.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Yves GAUTIER
: docteur en sciences de la Terre, concepteur de la collection
La Science au présent à la demande et sous la direction d'Encyclopædia Universalis, rédacteur en chef de 1997 à 2015 - Pierre SOUCHAY : professeur à l'université de Paris-VI-Pierre-et-Marie Curie et à l'École nationale supérieure de chimie, Paris
Classification
Médias
Autres références
-
ACÉTIQUE ACIDE
- Écrit par Jacques METZGER
- 2 113 mots
- 3 médias
L'acide acétique, acide organique de formule CH3COOH, est le membre le plus important de la famille des acides carboxyliques. Il joue avec ses dérivés un rôle essentiel dans de nombreuses synthèses et dégradations biologiques accompagnant le métabolisme des aliments et la formation des tissus....
-
ACIDES-ALCOOLS
- Écrit par Jacques METZGER
- 1 300 mots
- 1 média
Un acide-alcool est une molécule renfermant au moins une fonction acide carboxylique et une fonction alcool.
La nature nous en fournit de nombreux exemples : acides lactique du lait aigri, malique des pommes avant maturité (diacide-monoalcool), tartrique du tartre des vins (diacide-diacool), citrique...
-
ALCOOLS
- Écrit par Jacques METZGER
- 5 834 mots
- 8 médias
Lafonction alcool présente à la fois un caractère acide et un caractère basique. Son acidité se manifeste lorsqu'il est mis au contact d'une base : le proton est cédé à cette dernière et l'anion alcoolate formé ainsi que l'acide conjugué de la base se trouvent en équilibre avec l'alcool non dissocié... -
ALDÉHYDES ET CÉTONES
- Écrit par Jacques METZGER
- 7 356 mots
- 4 médias
Les principales méthodes de préparation des dérivés carbonylés mettant en œuvre la réduction du substrat concernent les acides et les fonctions dérivées. - Afficher les 40 références
Voir aussi
- PHOSGÈNE (oxychlorure de carbone)
- ANHYDRIDE SULFUREUX ou DIOXYDE DE SOUFRE
- SELS
- NEUTRALISATION, chimie
- DISSOCIATION IONIQUE
- OSTWALD LOI DE DILUTION D'
- IONS
- HYDROLYSE
- INDICATEURS COLORÉS
- ÉLECTRONÉGATIVITÉ
- HYDROGÈNE LIAISON
- EAU-FORTE
- LEWIS THÉORIE DE
- ÉLECTROPHILES RÉACTIONS
- IZMAÏLOV RUSTUM GADJIEVITCH (1909- )
- COORDINENCE ou NOMBRE DE COORDINATION
- ALCALI
- pK
- RÉACTIONNELS MÉCANISMES
- BRØNSTED-LOWRY THÉORIE DE
- AMPHOTÈRE CORPS
- AMPHOLYTE
- VINAIGRE
- PYROSULFURIQUE ACIDE
- BJERRUM NIELS (1879-1958)
- BASE, chimie
- CONSTANTE DE DISSOCIATION
- IONISATION
- EAU, physico-chimie
- FORCE D'UN ACIDE ou D'UNE BASE
- ÉQUILIBRE, chimie
- CATALYSEURS
- HYDROXYLE ou OXHYDRYLE
- ADDITION, chimie
- POLARISATION, chimie
- CONCENTRATION, chimie
- AMIDURES
- ÉCHANGE CHIMIQUE
- CONSTANTE DIÉLECTRIQUE
- NUCLÉOPHILES SUBSTITUTIONS
- NATRON
- pH
- AUTOPROTOLYSE RÉACTION D'
- STÉRIQUE EFFET ou EMPÊCHEMENT
- CHIMIE HISTOIRE DE LA
- SOLUTION, chimie
- PLUIES ACIDES
- DÉPLACEMENT CHIMIQUE
- CONSTANTE D'ÉQUILIBRE, chimie
- ACIDITÉ ÉCHELLE D'
- DONNEUR, chimie
- ACCEPTEUR, chimie
- PEARSON RALPH GOTTFRIED (1919- )