ACIDES & BASES
Article modifié le
Acidité et structure chimique
Liaisons chimiques
Le caractère acide d'une molécule HA repose principalement sur la nature de la liaison chimique entre H et le reste A de la molécule.
Électronégativité
Si A est un élément très électronégatif (attirant fortement le doublet électronique unissant A et H), la charge (—) se concentre vers A (donc la charge + vers H) ; à partir de cette liaison polarisée, l'ionisation de H, déjà amorcée, se trouvera facilitée, et l'acidité est accrue. On le vérifie, par exemple, en se déplaçant de gauche à droite sur une ligne du tableau périodique (électronégativités croissantes). Dans ces conditions, en descendant la colonne des halogènes (électronégativités décroissantes), l'acidité devrait diminuer dans le sens F, Cl, Br, I, alors qu'on constate le contraire. En réalité, les rayons atomiques croissent fortement dans le sens indiqué, ce qui accroît les distances séparant les charges opposées, d'où moindre attraction, donc ionisation plus facile ; ce dernier effet étant plus efficace que la diminution d'électronégativité, l'acidité augmente.
Effet inducteur
Si A est formé d'un groupe d'atomes (acides oxygénés), certains de ceux-ci peuvent drainer fortement les électrons, comme précédemment ; ce déplacement affectant l'ensemble des liaisons (effet inducteur), l'anion qui résulte de l'ionisation de l'acide voit sa charge négative mieux dispersée sur l'ensemble du squelette moléculaire et par conséquent sa stabilité accrue, l'acidité s'en trouve augmentée. C'est le cas de l'acide chloracétique (les ← représentant les déplacements), de pK 2,8 (contre 4,6 pour l'acide acétique).
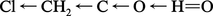
Cet effet est fortement atténué par l'augmentation de longueur de la chaîne ; très diminué pour l'acide β-chloropropanoïque :
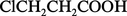
En chimie minérale, la règle de Pauling, approximative mais utile, donne la force en fonction du nombre n d'oxygènes non unis à H :

On peut l'expliquer en considérant que l'addition d'un nouvel oxygène (non relié à un H) provoque un déplacement d'électrons vers celui-ci, abaissant la force des autres liaisons O—H. Pour un ion chargé, la charge (—) créée par la première ionisation provoque un effet contraire du précédent (déplacement des électrons vers les autres atomes), renforçant ainsi la liaison O—H restante ; la deuxième acidité sera donc plus faible que la première ; l'écart de pK est de l'ordre de 5.
Exemple : H3PO4 : pK1 = 2 ; pK2 ≃ 7 ; pK3 ≃ 12.
Structures chimiques
Liaison hydrogène
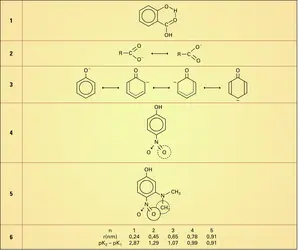
Lorsque le proton d'un acide se trouve, de par la structure moléculaire, dans le voisinage d'un atome porteur de doublets libres, il peut y avoir formation d'une liaison hydrogène, qui renforce l'acidité, car, H étant sollicité par l'atome donneur, la liaison OH se trouve relâchée. C'est le cas pour l'acide salicylique (formule 1, pK ≃ 3) plus acide que son isomère avec OH en para (pK ≃ 4,5) ; de même dans le cas des deux isomères géométriques fumarique et maléique, c'est ce dernier le plus acide, car il renferme les deux groupes carboxyle en position cis, la seule qui soit favorable pour une liaison hydrogène.
Mésomérie
Un acide carboxylique s'ionise en un anion mésomère (formule 2), si bien qu'en fait la charge négative est répartie entre les deux atomes d'oxygène, donnant une structure intermédiaire entre les précédentes (on dit qu'il y a résonance entre celles-ci). La structure réelle est toujours plus stable que celle des formes en résonance (la différence des énergies correspondantes est l'énergie de résonance). La forme ionisée étant stabilisée, elle se formera plus aisément, d'où accroissement du caractère acide par rapport à ce qu'on pourrait envisager.
En série aromatique, on explique ainsi le caractère plus acide du phénol par rapport aux alcools (pK≃ 10 contre 14 pour le méthanol), en invoquant la résonance de l'ion phénate (formule 3). Si, de plus, le noyau renferme des substituants, leur effet inducteur peut se superposer au précédent.
Effets stériques
Les effets précédents sont souvent compliqués par des effets stériques, chaque fois que des groupements volumineux d'atomes disposent d'un espace insuffisant pour les contenir, ce qui occasionne des contraintes ; pour s'y soustraire, la molécule se déforme. Ainsi, le paranitrophénol (formule 4) est un acide plus fort que son dérivé diméthylaminé (formule 5), car l'acidité de la fonction phénol est due aux possibilités de résonance, ce qui implique une structure plane.
Dans le deuxième corps, l'empiétement des groupements NO2 et N(CH3)2 empêche la planéité, d'où inhibition de la résonance et affaiblissement de l'acidité.
Citons également le cas des acides dicarboxyliques : HOCO(CH2)nCOOH, où l'ionisation du premier carboxyle entrave le départ du deuxième proton, par attraction électrostatique du CO2—. Cette attraction dépend de la distance r des carboxyles, donc de la longueur de la chaîne (n), d'où une relation entre pK2—pK1 et n, car r varie de façon régulière avec n, si la chaîne est peu pliée (formule 6).
L'introduction de certains substituants sur les carbones de la chaîne en raison de leur encombrement replie la molécule en amenant les carboxyles l'un vers l'autre, donc diminuant r, ce dont on s'aperçoit par la variation de pK2—pK1. On a constaté ainsi que, pour l'acide succinique (n = 2), r tombe de 4,5 à 2,1 pour son dérivé obtenu par substitution de deux groupes —CH2C6H5 (benzyle) sur le même carbone.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Yves GAUTIER
: docteur en sciences de la Terre, concepteur de la collection
La Science au présent à la demande et sous la direction d'Encyclopædia Universalis, rédacteur en chef de 1997 à 2015 - Pierre SOUCHAY : professeur à l'université de Paris-VI-Pierre-et-Marie Curie et à l'École nationale supérieure de chimie, Paris
Classification
Médias
Autres références
-
ACÉTIQUE ACIDE
- Écrit par Jacques METZGER
- 2 113 mots
- 3 médias
L'acide acétique, acide organique de formule CH3COOH, est le membre le plus important de la famille des acides carboxyliques. Il joue avec ses dérivés un rôle essentiel dans de nombreuses synthèses et dégradations biologiques accompagnant le métabolisme des aliments et la formation des tissus....
-
ACIDES-ALCOOLS
- Écrit par Jacques METZGER
- 1 300 mots
- 1 média
Un acide-alcool est une molécule renfermant au moins une fonction acide carboxylique et une fonction alcool.
La nature nous en fournit de nombreux exemples : acides lactique du lait aigri, malique des pommes avant maturité (diacide-monoalcool), tartrique du tartre des vins (diacide-diacool), citrique...
-
ALCOOLS
- Écrit par Jacques METZGER
- 5 834 mots
- 8 médias
Lafonction alcool présente à la fois un caractère acide et un caractère basique. Son acidité se manifeste lorsqu'il est mis au contact d'une base : le proton est cédé à cette dernière et l'anion alcoolate formé ainsi que l'acide conjugué de la base se trouvent en équilibre avec l'alcool non dissocié... -
ALDÉHYDES ET CÉTONES
- Écrit par Jacques METZGER
- 7 356 mots
- 4 médias
Les principales méthodes de préparation des dérivés carbonylés mettant en œuvre la réduction du substrat concernent les acides et les fonctions dérivées. - Afficher les 40 références
Voir aussi
- PHOSGÈNE (oxychlorure de carbone)
- ANHYDRIDE SULFUREUX ou DIOXYDE DE SOUFRE
- SELS
- NEUTRALISATION, chimie
- DISSOCIATION IONIQUE
- OSTWALD LOI DE DILUTION D'
- IONS
- HYDROLYSE
- INDICATEURS COLORÉS
- ÉLECTRONÉGATIVITÉ
- HYDROGÈNE LIAISON
- EAU-FORTE
- LEWIS THÉORIE DE
- ÉLECTROPHILES RÉACTIONS
- IZMAÏLOV RUSTUM GADJIEVITCH (1909- )
- COORDINENCE ou NOMBRE DE COORDINATION
- ALCALI
- pK
- RÉACTIONNELS MÉCANISMES
- BRØNSTED-LOWRY THÉORIE DE
- AMPHOTÈRE CORPS
- AMPHOLYTE
- VINAIGRE
- PYROSULFURIQUE ACIDE
- BJERRUM NIELS (1879-1958)
- BASE, chimie
- CONSTANTE DE DISSOCIATION
- IONISATION
- EAU, physico-chimie
- FORCE D'UN ACIDE ou D'UNE BASE
- ÉQUILIBRE, chimie
- CATALYSEURS
- HYDROXYLE ou OXHYDRYLE
- ADDITION, chimie
- POLARISATION, chimie
- CONCENTRATION, chimie
- AMIDURES
- ÉCHANGE CHIMIQUE
- CONSTANTE DIÉLECTRIQUE
- NUCLÉOPHILES SUBSTITUTIONS
- NATRON
- pH
- AUTOPROTOLYSE RÉACTION D'
- STÉRIQUE EFFET ou EMPÊCHEMENT
- CHIMIE HISTOIRE DE LA
- SOLUTION, chimie
- PLUIES ACIDES
- DÉPLACEMENT CHIMIQUE
- CONSTANTE D'ÉQUILIBRE, chimie
- ACIDITÉ ÉCHELLE D'
- DONNEUR, chimie
- ACCEPTEUR, chimie
- PEARSON RALPH GOTTFRIED (1919- )