- 1. Nomenclature
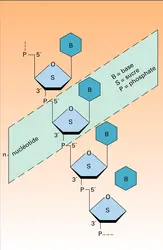
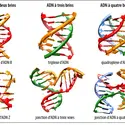
- 2. Structure des acides nucléiques
- 3. Synthèse totale des acides nucléiques
- 4. Propriétés physico-chimiques
- 5. Dénaturation de l'ADN. Hybrides moléculaires
- 6. Rôle de l'acide désoxyribonucléique
- 7. Rôle des acides ribonucléiques
- 8. Biosynthèse des acides nucléiques
- 9. Lésions et réparations de l'ADN
- 10. Pathologies réparationnelles
- 11. Bibliographie
NUCLÉIQUES ACIDES
Article modifié le
Lésions et réparations de l'ADN
Le matériel génétique des organismes vivants est exposé à des agents génotoxiques variés dont l'interaction directe ou indirecte (par l'intermédiaire de métabolites formés lors des réactions enzymatiques intracellulaires) avec l'ADN induit une importante gamme de lésions. Aussi l'état de l'ADN est-il contrôlé par des facteurs présents dans la cellule touchée, et, quand une lésion est repérée, des systèmes enzymatiques de réparation sont mobilisés afin d'éliminer les dommages et de restituer un ADN intact (réparation fidèle) ou incomplètement réparé (réparation source d'erreur).
En cas de réparation fidèle, il ne reste aucune trace de l'accident subi par l'ADN. Celui-ci reste donc le garant de la conformité au programme spécifique lors des reproductions cellulaires, impliquant – après réplication de l'ADN grâce à l'enzyme ADN-polymérase – le partage chromosomique qui caractérise la mitose, et assure la transmission d'un patrimoine génétique intact et identique d'une cellule mère à ses deux cellules filles. L'ADN reste aussi le support de l'information génétique que transcrit – au niveau des gènes en activité – la machinerie enzymatique dont l'acteur principal, l'ARN-polymérase, fabrique les ARN messagers indispensables à la synthèse des protéines cellulaires qui auront donc été codées par les gènes.
Par contre, s'il reste trace de la lésion subie par l'ADN, l'activité cellulaire peut être entravée ou déviée vers des modalités pathologiques se manifestant notamment par des anomalies du cycle cellulaire de mise en œuvre de l'information génétique, d'où l'importance cruciale du mécanisme de réparation. Celui-ci a en effet pour rôle de corriger ou de franchir la lésion, par coopération entre la machinerie réplicative (reproduction de l'ADN) et les systèmes enzymatiques réparateurs, lesquels fonctionnent de concert avec les systèmes de transcription de l'information génétique (formation d'ARN messager).
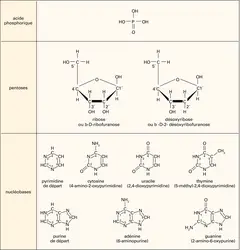
Les principales lésions de l'ADN
On notera d'abord que la molécule d'ADN peut être endommagée au niveau des bases puriques et pyrimidiques, support du code génétique. Ces bases peuvent être perdues ou désaminées, ou encore remplacées (changement tautomérique) par des substances analogues. Les bases peuvent aussi subir des réactions de méthylation ou d'éthylation par des agents alkylants (polluants de l'atmosphère, médicaments antitumoraux, etc.). Des produits d'addition sur les bases, produits extrêmement variés que l'on désigne par le terme d'adduits, résultent enfin de l'action nocive de nombreux agents génotoxiques tels que les hydrocarbures polycycliques contenus dans les produits de combustion (par exemple la fumée de cigarette).
La structure de la double hélice de l'ADN peut être perturbée par la formation de pontages intrabrin (entre deux bases adjacentes d'un même brin) ou interbrins (entre deux bases situées sur les brins homologues). Les ultraviolets germicides de 254 nanomètres (U.V.-C) provoquent la formation de ponts entre pyrimidines (ainsi devenues dimériques), alors que les antitumoraux bifonctionnels, tel le cisplatine, forment des ponts entre purines adjacentes. D'autre part, en s'intercalant entre deux étages ou plateaux des bases dans la double hélice de l'ADN, certaines molécules vont former des liaisons covalentes stables entre les bases portées par les brins opposés.
Les ruptures simple et double brin de l'ADN sont produites directement par des agents tels que les radiations ionisantes, et indirectement par l'action de radicaux libres. La destruction d'un désoxyribose entraîne une rupture des liaisons phosphodiesters au niveau du site lésé, donc une rupture du brin.
La diversité des lésions induites est illustrée par l'analyse des photoproduits stables détectés à la suite d'une irradiation par les U.V.-C. À côté des dimères de pyrimidines dus à la formation d'un noyau cyclobutanique, il se forme entre deux pyrimidines adjacentes des pyrimidines (6-4) pyrimidones ; la proportion relative des dimères de pyrimidine et de produit (6-4) est de 10 à 1. Leur efficacité respective dans l'effet léthal et dans l'effet mutagène des ultraviolets est également différente : les dimères ont un rôle cytotoxique plus important que les produits (6-4), alors que l'inverse est vrai pour l'effet mutagène. De même, les radiations ionisantes (rayons γ du cobalt 60 par exemple) produisent simultanément des ruptures simple ou double brin (approximativement dans un rapport de 9 à 1), de nombreux produits d'addition des bases, des pertes de bases et, aux fortes doses, des pontages entre ADN et protéines adjacentes (chromosomiques par exemple). On dénombre en moyenne une rupture de brin pour une base modifiée. Le rôle prédominant de la rupture double brin dans l'effet cytotoxique des radiations est accompagné d'un effet mutagène dû aux altérations des bases.
Les systèmes enzymatiques de réparation
Au cours des années 1960, des mutants sensibles aux agents génotoxiques ont été isolés à partir de la bactérie Escherichia coli et de la levure Saccharomyces cerevisiae. La caractérisation cellulaire et moléculaire des mutants, comparativement au type sauvage, a permis de préciser la notion de réparation de l'ADN lésé et de son contrôle génétique, puis de définir l'existence de voies métaboliques de réparation et d'en analyser les étapes. Quelques années plus tard se fait jour l'idée qu'il pouvait exister chez l'homme une relation entre un défaut génétique de réparation de l'ADN lésé et une prédisposition au cancer induit par un agent environnemental. C'est ainsi que les patients atteints d'une maladie génétique, le xeroderma pigmentosum (XP), sont affectés d'une photosensibilité extrême par suite de déficience de réparation de l'ADN des cellules malades (défaut d'excision des anomalies) ; ils développent en outre, avec une fréquence élevée, des cancers cutanés au niveau des zones tégumentaires ayant été exposées au soleil. Cette observation donna une grande impulsion à l'exploration des mécanismes reliant la réparation de l'ADN, la mutagenèse et la transformation maligne. Une corrélation deviendra évidente entre les activités mutagènes et cancérogènes de nombreux agents physiques et chimiques, et l'épidémiologie révélera l'importance de l'environnement dans l'incidence des cancers.
La réversion in situ de certaines lésions de l'ADN. Très spécifiques, ces systèmes mettent en œuvre une seule enzyme, qui élimine la lésion en une étape. C'est le cas de la photoréactivation qui intervient dans la réparation directe des dimères de pyrimidine par fixation de la photolyase (l'enzyme de réparation), activation de celle-ci par la lumière visible, coupure de la liaison cyclobutanique et restitution de la séquence d'ADN normal. Des mutants d'E. coli ou de levure, privés de photolyase, ne montrent pas, après irradiation par les U.V.-C, la restauration de la survie cellulaire ni la diminution de l'effet mutagène que devrait produire leur exposition à la lumière : la photoréactivation ne fonctionne donc plus.
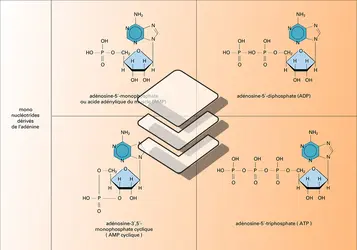
De même, les bases puriques alkylées sont directement déméthylées in situ par des méthyltransférases spécifiques (la O6-méthyl-guanine sera déméthylée par la O6-méthyl-guanine-transférase). Ou encore, des ruptures simples brins radio-induites seront directement jointées par une ADN-ligase qui soude les extrémités 3′-OH et 5′-phosphate adjacentes des brins coupés.
La réparation par excision-resynthèse. Ce processus multiétape implique la reconnaissance du site lésé, l'incision du brin d'ADN porteur de la lésion, l'excision du fragment d'ADN portant la (les) base(s) lésée(s) et la dégradation plus ou moins étendue du brin d'ADN. Cela est suivi, comme dans une réplication, du remplissage par l'ADN-polymérase de la brèche ainsi créée en prenant le brin d'ADN complémentaire intact comme matrice et enfin de la ligation par l'ADN-ligase du fragment néosynthétisé. Ce système, absent dans les mutants uvr A, uvr B, uvr C d'E. coli, dans les mutants de type RAD 3 de la levure S. cerevisiae, dans les mutants ERCC de cellules de hamster chinois et dans les cellules dérivées de patients XP, est capable de réparer diverses lésions. Il est présent dans tous les organismes de type sauvage.
– La réparation par excision de bases modifiées par alkylation, désamination hydrolytique, oxydation ou de bases mésappariées (adénine ou thymine mésappariée avec une guanine) implique des glycosylases, spécifiques des différents types de modifications. Ces enzymes coupent la liaison N-glycosylique entre l'adduit et le squelette désoxyribose-phosphate du brin d'ADN. Le site abasique ainsi créé est ensuite incisé par une AP-endonucléase qui clive le lien désoxyribosique phosphodiester en 3′ ou en 5′ de ce site. Une exonucléase excise ensuite le désoxyribose, produisant une brèche qui sera comblée par une ADN-polymérase ; la continuité de la séquence d'ADN est assurée par une ADN-ligase.
– La réparation par excision de nucléotides (dimère de pyrimidine, pontage interbrin ou un nucléotide modifié par un adduit encombrant) débute par la reconnaissance de la lésion, puis par l'incision de la liaison phosphodiester, en amont et en aval de la lésion – autrement dit en 3′ et 5′ – et avec un écart de quelques nucléotides de distance de part et d'autre de celle-ci. Le fragment porteur du dommage est excisé, et la brèche ainsi formée est comblée et ligaturée par les mêmes étapes que lors de l'excision de bases. Il a été démontré dans les cellules de mammifères, puis confirmé chez la levure et la bactérie E. coli que la réparation par excision est couplée à la transcription, en ce sens que le brin où sont transcrits des gènes actifs est réparé en premier, puis les lésions sont éliminées du brin complémentaire, et enfin les autres régions, non actives, du génome sont réparées. Cette séquence d'événements, dite « réparation préférentielle », permet de lever l'inhibition de la synthèse d'ARN qui a été bloquée par la présence d'une lésion.
Chez l'homme, le défaut biochimique à la base du xeroderma pigmentosum concerne l'une des premières étapes du mécanisme d'excision de nucléotides. Sept groupes génétiques ont été identifiés, et la plupart de ces gènes ont été clonés. Le XP groupe A code pour une protéine d'association à l'ADN ; les gènes XP B et XP D contrôlent la synthèse d'ADN-hélicases, enzymes essentielles à la disjonction des brins d'ADN par coupure des ponts hydrogène qui permettra réplication et transcription ; XP C code pour une protéine hydrophile dont la fonction est mal définie, bien qu'il soit démontré que le produit du gène XP C est spécifiquement requis pour la réparation des régions inactives du génome (chez la levure, l'homologue de XP C, RAD 23, interagit avec le facteur de transcription TFIIH). Le gène XP G code pour une endonucléase spécifique de l'ADN simple brin qui clive l'ADN endommagé du côté 3′ de la lésion. D'autres gènes humains, capables de corriger le défaut d'excision chez des mutants U.V.-sensibles de levure, ont été clonés ; il s'agit des gènes ERCC 1 et ERCC 4. Leur fonction est mal connue ; il a été suggéré que certaines des protéines qu'ils codent seraient des éléments constitutifs de la chromatine humaine et faciliteraient les étapes précoces de reconnaissance de nucléotides modifiés.
– La réparation des mésappariements de bases permet l'excision de nucléotides non modifiés mais anormalement appariés. Ces mésappariements résultent d'erreurs introduites par l'ADN-polymérase lors de la réplication de l'ADN (1 erreur pour 107 nucléotides incorporés). L'étude de mutants d'E. coli doués d'une forte capacité à subir des mutations spontanées (phénotype « mutateur ») a permis d'analyser le processus de réparation des mésappariements. Celui-ci requiert une discrimination du brin nouvellement synthétisé (il est hypométhylé dans le cas d'E. coli). La protéine Mut S reconnaît l'ADN mésapparié et s'y fixe, la protéine Mut L stabilise le complexe et permet à une troisième protéine Mut H de cliver, par son activité endonucléasique, le brin d'ADN non méthylé. L'activité de l'hélicase ATP-dépendante Uvr D (ou Mut U) est requise pour l'étape d'excision par une des exonucléases simple brin. L'ADN-polymérase, puis une ligase comblent la brèche ainsi formée.
Une déficience de ce système de réparation des mésappariements est impliquée dans le cancer héréditaire du côlon dit hereditary non polyposis cancer colon (HNPCC). Les gènes humains homologues des gènes bactériens codant pour Mut S et Mut L ont été identifiés, et ils sont mutés dans 90 p. 100 des cas de HNPCC. Dans les tumeurs, la copie de l'allèle normal est mutée ou perdue, induisant une déficience complète de la réparation des mésappariements et une accumulation de mutations dans d'autres gènes. Il est à noter que, chez l'homme, au moins trois gènes codent pour des protéines homologues de Mut L bactériens (hMLH 1, hPMS 1 et hPMS 2) et au moins deux gènes codent pour des protéines homologues de Mut S (hMSH 2 et GTBP).
Les mécanismes de tolérance des lésions
Si les mécanismes de réparation fidèles sont saturés, certains dommages vont bloquer la progression de la réplication de l'ADN. Deux solutions sont appliquées par les ADN-polymérases qui assurent la réplication dans les cellules en cours de reproduction (mitose) :
– Elles insèrent au hasard une base quelconque en face de la lésion et la dépassent. Cela permet à la cellule de survivre, mais avec une probabilité élevée de comporter une mutation. Si celle-ci ne survient pas dans une région essentielle du génome, cette réparation source d'erreur sera sans conséquence. En revanche, si elle survient dans un gène essentiel (proto-oncogène, suppresseur de tumeur), la réparation infidèle se traduira par l'initiation de la transformation maligne des cellules touchées.
– Elles laissent une brèche et réinitient la réplication en amont de la lésion. La discontinuité ainsi créée est résolue par la mise en œuvre d'un système enzymatique de recombinaison. L'information génétique du brin intact est transférée vers le brin porteur de la brèche en face de la lésion. La molécule d'ADN néosynthétisée sert de matrice pour reconstituer le brin échangé. La lésion, encore présente à la suite de la mitose, sera éliminée ensuite par le système d'excision. Les cassures double brin d'ADN produites par les radiations ionisantes ou au cours de la réparation par excision de deux lésions très voisines portées par chacun des deux brins d'ADN seront de la même manière réparées par ce système de recombinaison. Chez la levure S. cerevisiae, huit gènes au moins sont impliqués dans la réparation par recombinaison. Les mutants RAD 50 à RAD 57 sont hypersensibles aux radiations ionisantes et sont défectifs dans la recombinaison.
Rôle de la protéine p53
La coordination des événements associés à la progression des cellules dans leur cycle de reproduction est essentielle pour la transmission d'un matériel génétique non endommagé. Le cycle cellulaire se décompose en quatre phases de durée différente : la phase G1, la plus longue, essentiellement transcriptionnelle, prépare la synthèse réplicative de l'ADN, qui a lieu en phase S et après la phase G2, au cours de laquelle sont mis en place les matériaux génétiques (notamment ADN dupliqué) et les facteurs réglant le partage mitotique, intervient la phase M de déroulement de la mitose. Des molécules assurent et coordonnent les transitions d'une phase du cycle à la suivante. Les kinases dépendantes des cyclines (CDK) sont des enzymes porteuses de l'activité catalytique (phosphorylation d'autres protéines), stimulée par les cyclines auxquelles elles s'associent. Leur quantité varie en fonction de la situation des cellules dans le cycle. Le produit du gène du rétinoblastome (Rb), suppresseur de tumeur, joue un rôle important dans le passage des points de contrôle : inactivé lorsqu'il est phosphorylé, il se dissocie des facteurs de transcription de la famille E2F et permet l'expression des gènes impliqués dans la réparation de l'ADN par excision de nucléotides. La protéine p53, autre suppresseur de tumeur, est également un relais moléculaire important dans le contrôle du cycle cellulaire. Les dommages produits dans l'ADN par les radiations ou par certains agents chimiques provoquent une accumulation de cette protéine dans le noyau de cellules de mammifères. Ce sont les ruptures de la molécule d'ADN qui stabilisent la protéine p53. Les patients atteints du syndrome héréditaire de Li-Fraumeni sont hétérozygotes pour le gène P53 (un allèle normal plus un allèle muté) ; ils ont un risque accru de développer un cancer. Chez la souris, la destruction de l'un ou des deux gènes P53 normaux entraîne une grande sensibilité à la tumorigenèse radio-induite, puis la mort précoce par cancer.
La protéine p53 est impliquée dans l'arrêt des cellules dans la phase G1 du cycle cellulaire et dans la transition de la phase G1 à la phase S, laissant ainsi aux systèmes de réparation le temps d'éliminer les lésions avant qu'elles ne soient fixées en mutation lors de la réplication. Les cellules dérivées de patients atteints d'ataxie-télangiectasie ne présentent pas cet arrêt en phase G1, caractéristique des cellules normales soumises à irradiation ionisante ; elles ne montrent pas l'augmentation radio-induite de l'activité de la protéine p53 et des produits des gènes contrôlés par celle-ci (GADD 45, MDM 2 et p21). Ainsi cette maladie génétique, caractérisée par une hypersensibilité aux radiations ionisantes, une prédisposition au cancer et des anomalies de recombinaison génétique, est-elle associée à des altérations du cycle cellulaire au niveau d'étapes contrôlées par la protéine p53, qui est le « gardien du génome ».
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques KRUH : docteur en médecine, docteur ès sciences, professeur de biochimie à la faculté de médecine de Cochin-Port-Royal
- Ethel MOUSTACCHI : directeur de recherche de classe exceptionnelle au C.N.R.S., unité 1292 (génotoxicologie et réparation de l'ADN)
- Michel PRIVAT DE GARILHE : ingénieur-docteur, docteur ès sciences, professeur au Conservatoire national des arts et métiers, ingénieur E.S.C.I.L.
- Alain SARASIN : directeur de recherche au C.N.R.S., directeur de l'Institut de recherche sur le cancer, agrégé de l'Université
Classification
Médias
Autres références
-
ADN (acide désoxyribonucléique) ou DNA (deoxyribonucleic acid)
- Écrit par Michel DUGUET , Encyclopædia Universalis , David MONCHAUD et Michel MORANGE
- 10 074 mots
- 10 médias
Le 25 avril 1953, l'Américain James D. Watson et le Britannique Francis H. C. Crick, récipiendaires, en 1962, avec le Britannique Maurice Wilkins du prix Nobel de physiologie ou médecine, proposaient, dans la célèbre revue scientifique anglaise Nature, une structure tridimensionnelle... -
ALTMAN SIDNEY (1939-2022)
- Écrit par Georges BRAM et Encyclopædia Universalis
- 377 mots
Le biochimiste américain d'origine canadienne Sidney Altman est né le 7 mai 1939 à Montréal (Canada). Après des études de physique au Massachusetts Institute of Technology (MIT) à Cambridge et une année à l'université Columbia à New York, il fait, à l'université de Boulder (Colorado), des recherches...
-
ANTIGÈNES
- Écrit par Joseph ALOUF
- 7 384 mots
- 5 médias
L'immunogénicité des acides nucléiques, longtemps niée, est désormais bien établie, mais ne concerne que certains acides ribonucléiques (ARN) et désoxyribonucléiques (ADN). Les autoanticorps anti-ADN caractérisent certaines maladies auto-immunes (lupus érythémateux disséminé). Enfin, certains lipides... -
ARN (acide ribonucléique) ou RNA (ribonucleic acid)
- Écrit par Marie-Christine MAUREL
- 2 772 mots
- 2 médias
Faut-il voir dans une molécule biologique omniprésente dans toute structure cellulaire des êtres vivants, l'ARN (acide ribonucléique), la première étape de l'histoire de la vie ? Les ARN contemporains sont-ils les fossiles d'anciennes molécules ? Les voies métaboliques primordiales...
- Afficher les 39 références
Voir aussi
- INTERFÉRON
- ENZYMES
- ADN RÉPÉTITIF
- MATURATION DE L'ARN
- PROMOTEUR, biologie moléculaire
- GÈNES EN MOSAÏQUE
- HYDROGÈNE LIAISON
- MICROSATELLITES, génétique moléculaire
- ATAXIE-TÉLANGIECTASIE
- PHOTOSENSIBILITÉ, biologie
- MICROSCOPIE ÉLECTRONIQUE
- HYBRIDATION MOLÉCULAIRE
- PURINES
- ADN RÉPARATION DE L'
- LI-FRAUMENI SYNDROME DE
- HÉRÉDITAIRES MALADIES ou MALADIES GÉNÉTIQUES
- GUANINE
- NUCLÉOSIDES
- NUCLÉOTIDES
- ADN POLYMÉRASE
- CODON, biologie moléculaire
- ARN DE TRANSFERT ou ARNt
- ARN MESSAGER ou ARNm
- ARN POLYMÉRASE
- CYTOSINE
- ADÉNINE
- THYMINE
- RÉPLICATION, biologie moléculaire
- TRANSCRIPTION, biologie moléculaire
- TRADUCTION, biologie moléculaire
- POLYNUCLÉOTIDE
- URACILE
- COCKAYNE SYNDROME DE
- PYRIMIDINES
- STRUCTURE, biologie
- NUCLÉASES
- RAYONNEMENTS IONISANTS ou RADIATIONS IONISANTES
- CHLORURE DE CÉSIUM
- PHOSPHORIQUES ACIDES
- SÉQUENÇAGE, génétique moléculaire
- SÉPARATION, chimie
- GÈNE P53
- MASSE MOLÉCULAIRE
- PHOSPHORYLATION
- LIGASES
- ARN POLYMÉRASE ARN-DÉPENDANTE
- AVERY OSWALD THEODORE (1877-1955)
- GÉNOME
- BIOLOGIE MOLÉCULAIRE
- RIBOSE
- DÉSOXYRIBOSE
- HISTONES
- TRICHOTHIODYSTROPHIE
- DIVISION CELLULAIRE
- BIOSYNTHÈSES
- PROTÉINES BIOSYNTHÈSE DES
- INFORMATION GÉNÉTIQUE
- RECOMBINAISON GÉNÉTIQUE
- TRANSFORMATION BACTÉRIENNE
- TRANSDUCTION BACTÉRIENNE
- RÉGULATION GÉNÉTIQUE
- PATRIMOINE GÉNÉTIQUE
- EXPRESSION GÉNÉTIQUE
- EXON
- INTRON
- CONJUGAISON BACTÉRIENNE
- ARABINOSIDES
- ENZYMOPATHIES
- NUCLÉOTIDIQUE SÉQUENCE
- GÉNÉTIQUE MOLÉCULAIRE
- STAHL FRANKLIN WILLIAM (1929- )
- MOLÉCULES BIOLOGIQUES, structure et fonction
- MACROMOLÉCULES BIOLOGIQUES
- ANTICODON, génétique moléculaire
- ARN RIBOSOMIQUE ou ARNr
- CYTOTOXICITÉ
- CYCLE CELLULAIRE
- PEAU CANCER DE LA
- SPECTRE D'ABSORPTION
- PROTÉINES
- CÔLON CANCER DU
- ÉPISSAGE, génétique moléculaire
- MÉTHYLATION, biologie moléculaire
- MUTAGENÈSE
- TRANSCRIPTASE INVERSE ou REVERSE TRANSCRIPTASE
- DÉFICITS ENZYMATIQUE & MÉTABOLIQUE
- HÉLICASES
- BASES NUCLÉIQUES ou BASES AZOTÉES
- LYNCH SYNDROME DE