- 1. L'océan, un régulateur de la teneur en dioxyde de carbone de l'atmosphère
- 2. La chimie de l'océan et le dioxyde de carbone
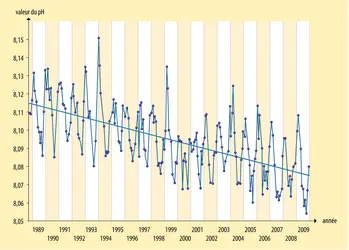
- 3. Mesure de la décroissance du pH de l'océan
- 4. Baisse du pH et perturbation des carbonates
- 5. Quels sont les impacts pour les écosystèmes marins ?
- 6. Bibliographie
- 7. Sites internet
ACIDIFICATION DES OCÉANS
Article modifié le
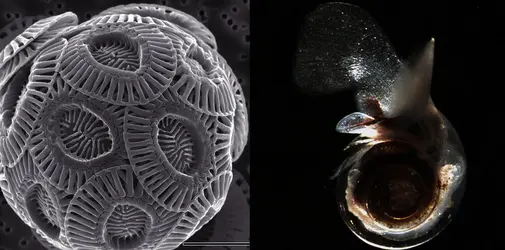
Par sa capacité à dissoudre les gaz atmosphériques responsables de l'effet de serre, l'océan joue un rôle essentiel dans la régulation du climat. Toutefois, l'absorption de l'excès de dioxyde de carbone (CO2) rejeté par les activités humaines (anthropiques) depuis 1850 perturbe la chimie de l'océan mondial. Elle se traduit par une diminution sensible du pH (potentiel hydrogène) de l'eau, c'est-à-dire une acidification de l'océan. Ce phénomène menace potentiellement les organismes qui possèdent un squelette ou une coquille calcaire. En effet, le calcaire est instable en milieu acide et se dissout. Ces organismes sont-ils condamnés à disparaître ? Certaines espèces sont-elles capables de s'adapter aux variations de l'environnement ?
L'océan, un régulateur de la teneur en dioxyde de carbone de l'atmosphère
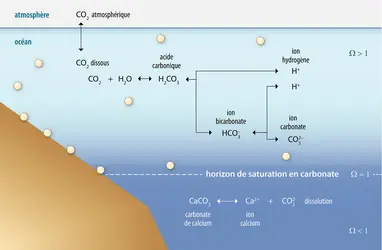
L'eau de mer solubilise les gaz de l'atmosphère, et plus particulièrement le CO2. Au total, l'océan mondial contient soixante-cinq fois plus de carbone sous forme de CO2 que l'atmosphère. C'est donc lui qui contrôle la composition de l'atmosphère en CO2 et non l'inverse. Depuis 1850, il a absorbé environ le tiers des flux de CO2 émis par les activités humaines. Le CO2 étant un gaz impliqué dans l'effet de serre, si l'océan n'existait pas, le réchauffement de la Terre serait donc beaucoup plus important que celui que nous connaissons. Cependant, ce processus présente un effet collatéral négatif : l'eau de mer enrichie en CO2 « s'acidifie ». Le pH (calculé par le logarithme décimal de l'inverse de la concentration en ions hydrogène H+) est le paramètre qui qualifie l'acidité d'une solution : celle-ci est neutre lorsque le pH est égal à 7, acide lorsqu'il est inférieur à cette valeur et basique lorsqu'il est supérieur. Depuis l'ère industrielle, le pH de l'océan, basique, est passé de 8,2 à 8,1. Cette baisse de 0,1 unité correspond à une augmentation de l'acidité de l'ordre de 25 p. 100. En se fondant sur le scénario le plus pessimiste du G.I.E.C. (Groupe d'experts intergouvernemental sur l'évolution du climat), mais qui, hélas, n'est pas improbable, on peut prévoir une décroissance du pH de l'eau de mer de 0,35 unité à la fin du xxie siècle.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Paul TRÉGUER : professeur émérite à l'université de Brest
Classification
Médias
Autres références
-
OCÉANOGRAPHIE
- Écrit par Patrick GEISTDOERFER
- 10 054 mots
- 11 médias
...bonne partie) responsable, avec les autres gaz à effet de serre (comme le méthane), du changement climatique de notre planète. Ce déséquilibre entraîne une acidification de l’eau de mer (diminution du pH) dont les conséquences sont néfastes pour les récifs coralliens et pour certains organismes à la... -
PLANCTON
- Écrit par Stéphane GASPARINI
- 3 266 mots
- 9 médias
...boucle microbienne peu favorable aux espèces exploitées. Une autre conséquence de l'augmentation du niveau de dioxyde de carbone dans l'atmosphère est une diminution progressive du pH des océans : on parle d'acidification des océans. Ce phénomène menace l'équilibre des carbonates, lequel... -
RÉCIFS CORALLIENS
- Écrit par Pascale JOANNOT
- 6 439 mots
...d'augmenter dans l'atmosphère, sa dissolution croissante dans l'eau de mer entraînera une augmentation de l'acide carbonique (H2CO3), ce qui provoquera une acidification de l'eau de mer. En effet, l'eau, en se combinant avec le CO2, forme de l'acide carbonique qui a la particularité de dissoudre...
Voir aussi
- CARBONIQUE ACIDE
- OCÉANOGRAPHIE ET OCÉANOLOGIE
- CARBONATE ION
- SOLUBILITÉ
- CALCITE
- ARAGONITE
- pH
- EAU DE MER
- BICARBONATE
- MOULE, zoologie
- MARINE BIOLOGIE
- GAZ À EFFET DE SERRE
- CORAIL
- COQUILLE
- ANTHROPISATION
- HUÎTRE
- EXOSQUELETTE
- TEST, zoologie
- CARBONIQUE GAZ ou DIOXYDE DE CARBONE
- CARBONATE DE CALCIUM
- EPOCA (European Project on Ocean Acidification)