ACTIVITÉ, chimie
Article modifié le
Grandeur introduite par G. N. Lewis, en 1907, pour exprimer les propriétés thermodynamiques des solutions. En effet, l'expression du potentiel chimique d'un composé dans une solution idéale, donné par la relation μ = kT ln N + μ0, où N représente la fraction molaire du composé, n'est valable que dans le cas où la concentration du composé tend vers zéro, c'est-à-dire dans le cas des solutions infiniment diluées. Dans le cas d'une solution réelle, on considère l'activité du composé, et l'expression du potentiel chimique devient alors μ = kT ln a + μ0, l'activité a du composé est égale à Nf, où f représente le coefficient d'activité exprimant l'écart d'une solution réelle à l'idéalité.
De la même façon, l'expression de l'équation cinétique d'une réaction chimique, telle la réaction 1 + 2 → 3 + 4, en fonction de la concentration des réactifs, soit v = k . [1] . [2], n'est valable que pour des solutions infiniment diluées, lorsque ces concentrations tendent vers zéro. C'est l'activité des réactifs 1 et 2 (respectivement a1 et a2) qui intervient dans v = k . a1 . a2, où a1 = f1 . [1] et a2 = f2 . [2]. Il en est de même pour l'expression des constantes d'équilibre.
Concrètement, l'activité d'une entité réagissante traduit sa disponibilité pour la réaction considérée. Par exemple, l'activité d'une entité fortement solvatée, donc accaparée par les molécules de solvant, augmente si on provoque la désolvatation.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Dina SURDIN : auteur
Classification
Autres références
-
ÉTAT STANDARD
- Écrit par Didier LAVERGNE
- 40 mots
Quand une substance pure est dissoute à la concentration de 1 mole par litre, à la pression de 1 atmosphère et à la température de 25 0C, elle est à l'état standard et se trouve à l'activité thermodynamique unité.
-
SOLUTION ÉQUILIBRES EN
- Écrit par Claude COLIN et Alain JARDY
- 9 586 mots
- 16 médias
– l' activité des solutés, présents en solution diluée (< 1 mol . l-1), est assimilée à leur concentration (notée | | ) ; en fait, ai = γiCi, avec γi coefficient d'activité tendant vers 1 quand C → 0 ; -
THERMODYNAMIQUE - Thermodynamique chimique
- Écrit par Pierre SOUCHAY
- 7 194 mots
- 3 médias
...Cependant, lorsque ci ou les concentrations des autres solutés croissent, le comportement se complique et μi devient de la forme :où ai est l' activité : c'est la concentration fictive que devrait adopter l'espèce i pour continuer à présenter le comportement des solutions diluées....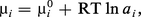
Voir aussi



