ADSORPTION
Article modifié le
Applications
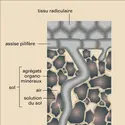
La physisorption sur les solides est fréquemment mise à profit pour la séparation et la purification des gaz ou la séparation de solutés dans les liquides. On utilise le plus souvent les charbons actifs, mais on dispose aussi d'adsorbants comportant des pores de dimensions moléculaires (comme les zéolites) qui leur confèrent une certaine sélectivité en fonction de la taille et de la forme des molécules. L'analyse chromatographique est basée sur les temps de séjour différents à l'état adsorbé des molécules d'un mélange gazeux ou liquide au cours de sa progression le long d'un adsorbant. La physisorption est enfin la seule méthode dont on dispose pratiquement pour mesurer l'aire des solides poreux ou pulvérulents (catalyseurs, pigments...).
La chimisorption est responsable de la présence constante de couches adsorbées (oxygène, eau, dioxyde de carbone...) à la surface des solides. Il en résulte de grandes difficultés expérimentales pour la préparation et l'étude des surfaces propres : sous une pression de 1 milliardième d'atmosphère, il peut suffire de quelques secondes pour que la surface soit contaminée par une couche chimisorbée ; cela explique la nécessité de pressions des milliers de fois plus faibles (ultravide). Mais l'intérêt essentiel de la chimisorption est de permettre de mieux comprendre le rôle des intermédiaires réactionnels responsables de l'activité et de la spécificité des catalyseurs solides qui jouent un rôle considérable dans l'industrie chimique.
Dans les liquides, l'adsorption joue un rôle déterminant dans la stabilité des états de dispersion d'autres phases (mousses, émulsions, colloïdes). Ces propriétés sont mises à profit dans l'industrie des détergents.
L'adsorption joue un rôle important dans les phénomènes d'adhésion entre surfaces de solides. Elle intervient inévitablement dans le mécanisme de la croissance des cristaux, par migration de molécules à l'état adsorbé. Enfin, l'étude des domaines d'existence et de la structure des phases bidimensionnelles a approfondi nos connaissances sur les états de la matière.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Xavier DUVAL : professeur à l'université de Nancy-I
Classification
Médias
Autres références
-
ABSORPTION VÉGÉTALE
- Écrit par René HELLER et Jean-Pierre RONA
- 4 441 mots
- 6 médias
...ions ainsi constituée, est un facteur très important dans la nutrition des plantes : alors que les ions dissous risquent d'être entraînés par les pluies, les ions adsorbés résistent au lessivage et ne sont libérés qu'au fur et à mesure des besoins de la plante. Les anions, comme NO3—, qui ne... -
ANALYTIQUE CHIMIE
- Écrit par Alain BERTHOD et Jérôme RANDON
- 8 890 mots
- 4 médias
Une phase solide peut être utilisée pour séparer un soluté d'une phase liquide. L'extraction liquide-solide utilise la réaction physico-chimiqued'adsorption. Le soluté se fixe alors sur la surface solide de l'adsorbant. Le charbon actif, ou noir de carbone, est très utilisé pour extraire... -
CATALYSE
- Écrit par Henri Jean-Marie DOU et Jean-Eugène GERMAIN
- 8 396 mots
- 7 médias
...semblable à lui-même, capable de poursuivre indéfiniment le même effet. » Ce point de vue était opposé à l'explication dite « physique » de la catalyse par l' adsorption dans les pores du solide, qui provoquerait une concentration locale élevée de réactifs. Nous savons maintenant que les phénomènes d'adsorption... -
CHROMATOGRAPHIE
- Écrit par Robert ROSSET , Louis SAVIDAN et Alain TCHAPLA
- 17 046 mots
- 8 médias
...l'espace le plus restreint possible. Soient respectivement α et β les fractions de A et B qui se trouvent en phase liquide à la température de l'expérience. Celles qui sont adsorbées sur la phase stationnaire sont alors 1 — α et 1 — β. Pour que A soit séparé de B, il faut que les rapports de distribution 1 — α/α... - Afficher les 14 références
Voir aussi