AGRÉGATS, physico-chimie
Agrégats colloïdaux
Les colloïdes sont des billes solides, électriquement chargées, en suspension dans un liquide. À cause de leurs charges de surface, ces sphères se repoussent, ce qui confère une remarquable stabilité à la suspension. Cependant, lorsqu'on introduit des ions de charge opposée dans la solution, ceux-ci viennent se regrouper autour des colloïdes pour former un écran électrostatique. Cela permet de restaurer, entre les édifices neutres ainsi constitués, les attractions de courte portée de Van der Waals, et le phénomène d'agrégation se produit. Tant qu'elles restent éloignées les unes des autres, les billes diffusent, elles se déplacent dans la solution selon un mouvement brownien. Mais, si deux sphères s'approchent suffisamment, elles subissent l'attraction de Van der Waals, et elles se soudent pour former un petit agencement rigide qui diffuse lui aussi et qui peut rencontrer d'autres colloïdes ou d'autres ensembles. Ainsi des agrégats se forment et grossissent. Ils peuvent contenir jusqu'à plusieurs dizaines de milliers de billes et atteindre des tailles de l'ordre de quelques dixièmes de millimètres. Cependant, lorsqu'ils dépassent cette taille, leur poids n'est plus négligeable et ils commencent à précipiter. Généralement, lors de leur dépôt, ils se brisent et se tassent. Des mécanismes similaires se produisent en atmosphère gazeuse avec les aérosols (formation de la fumée). Des bases théoriques pour décrire la cinétique de ce mécanisme ont été introduites par von Smoluchowski en 1916.
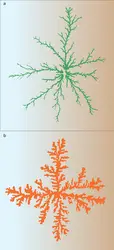
Structure fractale des agrégats colloïdaux
L'analyse numérique des photos de microscopie électronique a permis de découvrir que les agrégats de colloïdes ou d'aérosols, résultant du mécanisme décrit ci-dessus, étaient des structures fractales, selon la terminologie introduite par le mathématicien Mandelbrot en 1974. Les billes ne se disposent ni en ligne ni en boule compacte, mais selon une structure intermédiaire ramifiée et désordonnée, dictée par le hasard des collages. Cette structure se caractérise par un nombre, la dimension fractale, compris entre 1 (dimension d'une ligne) et 3 (dimension d'une boule). La nature fractale des agrégats colloïdaux a été confirmée par de nombreuses expériences comme la diffusion des neutrons, de la lumière ou des rayons X. Cette description permet de mieux interpréter leurs propriétés physiques (propriétés mécaniques, stabilité, etc.) ainsi que celles des solutions qui les contiennent (conductivité, rhéologie, etc.).
Modèles d'agrégation
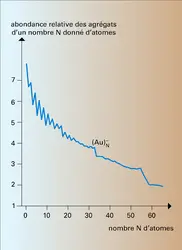
Pour comprendre la structure fractale des agrégats colloïdaux, les théoriciens ont proposé des modèles capables de simuler les phénomènes d'agrégation. Bien que de conception très simple, ces modèles se prêtent mal aux calculs analytiques et ce sont surtout des calculs numériques à l'ordinateur qui ont permis de les étudier. Le premier fut proposé en 1981 par les physiciens américains T. Witten et L. Sander : des particules browniennes viennent se coller, une à une, sur un agrégat qui pousse à partir d'un germe central. Cela permet d'expliquer la formation des agrégats métalliques qu'on obtient à la cathode par électrolyse d'un sel métallique. Des équivalences formelles, entre les équations de la diffusion et celles régissant d'autres phénomènes physiques, permettent à ce modèle d'acquérir un champ d'application beaucoup plus vaste qui dépasse celui des agrégats, comme la forme et le mécanisme de croissance des éclairs, les lignes de fracture des matériaux sous contrainte ou l'interface obtenue lorsqu'on force un liquide à pénétrer dans un autre plus visqueux que lui. Un autre modèle, où des agrégats de toutes tailles diffusent et se collent entre eux, a été introduit en 1983, aux États-Unis et en France. Il permet de décrire quantitativement la structure des agrégats colloïdaux. De nombreuses extensions[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean FARGES : professeur à l'université de Paris-Sud
- Rémi JULLIEN : professeur
Classification
Médias
Autres références
-
COLLOÏDES
- Écrit par Didier ROUX
- 6 009 mots
La forme et la taille de ces agrégats dépendent des propriétés des molécules qui les constituent et peuvent prendre des aspects divers. Plus précisément, les tailles respectives de la partie polaire et de la partie aliphatique des molécules permettent de mieux comprendre la forme des agrégats. Pour cela,... -
MOLÉCULAIRES JETS & FAISCEAUX
- Écrit par Roger CAMPARGUE
- 5 686 mots
- 3 médias
...encore faire intervenir la chaleur libérée par ce processus. On a alors la possibilité intéressante de pouvoir créer dans le jet supersonique des agrégats moléculaires (clusters) allant depuis les molécules de van der Waals regroupant de deux à quelques atomes jusqu'à des microgouttelettes, ou des...