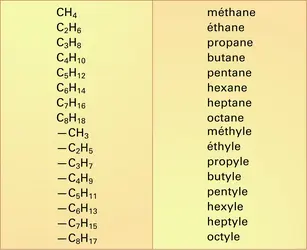
ALCANES
Propriétés chimiques
Les électronégativités du carbone sp3 et de l'hydrogène étant très voisines, la molécule d'alcane est pratiquement apolaire et, de ce fait, elle n'a pas d'affinité pour les réactifs ioniques (électrophiles, nucléophiles). Les principales réactions sont de nature radicalaire : substitution, élimination et fragmentation radicalaires.
Réactions de coupure des liaisons C−C et C−H
Thermodynamiquement les alcanes, à l'exception du méthane, sont instables par rapport à leurs éléments, c'est-à-dire que, à la température ordinaire, leur réaction de décomposition en carbone et hydrogène est exothermique. Toutefois, la vitesse de cette réaction ne devient appréciable qu'à une température relativement élevée : 650 0C pour l'éthane, 500 0C pour le propane et qui tend vers une limite de 400 0C pour les termes de condensation en carbone plus élevée.
Craquage et isomérisation
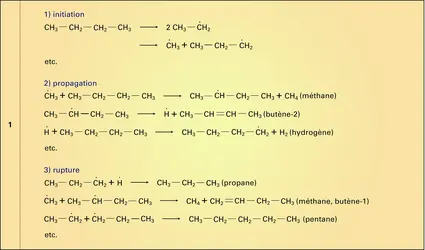
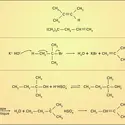
Portés pendant un temps très court (de 0,5 à 2 s) à une température élevée (700-850 0C), les alcanes en C5-C9, qui sont les principaux constituants des coupes de distillation des pétroles appelées naphtas, subissent une série de réactions de fragmentation homolytique et de recombinaison qui les transforment en un mélange de molécules à chaîne plus courte, saturées (alcanes) et insaturées (alcènes, alcadiènes). C'est la réaction de craquage thermique, généralement pratiquée en présence de vapeur d'eau afin de diminuer la pression partielle des hydrocarbures (vapocraquage). Sous l'action de la température se produit la coupure homolytique de liaisons C−C qui conduit à des radicaux libres dont la réaction avec d'autres molécules et d'autres radicaux est responsable de la formation des molécules plus courtes, saturées ou non (réactions 1).
La rupture des liaisons C−C se produit préférentiellement à celle des liaisons C−H par suite de l'importante différence d'énergie de dissociation de ces liaisons (345 kJ/mole et 413 kJ/mole). Réalisée sur d'importants tonnages d'hydrocarbures, l'opération de vapocraquage du naphta transforme en France, annuellement, quelque 8 millions de tonnes de pétrole en éthylène (2 Mt), propylène (1,2 Mt) et autres hydrocarbures courts en C4, matières premières essentielles de la chimie de base (cf. pétrole - Pétrochimie).
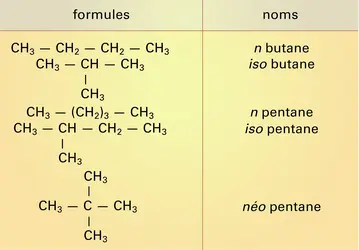
En présence de catalyseurs acides, les alcanes en C4 et plus subissent une isomérisation réversible. À la température ordinaire, l'équilibre s'établit lentement et le rendement en isomères ramifiés est maximal. À température plus élevée, la vitesse d'isomérisation augmente mais le pourcentage en isomères ramifiés diminue. Cette réaction est pratiquée industriellement pour transformer les alcanes normaux en C4, C5, C6 en isomères ramifiés, qui apportent aux essences un indice d'octane élevé, le butane normal en isobutane en vue de la synthèse (procédé Oxirane) de l'oxyde de propylène et du tertiobutanol.
Alkylation
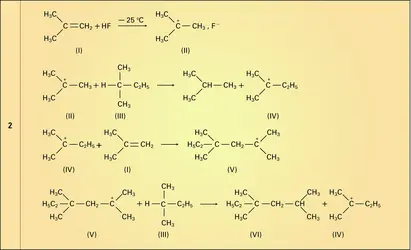
L' alkylation, par les alcanes ramifiés, des alcènes ramifiés est une réaction d'importance industrielle pour la production de carburants à haut indice d'octane. C'est l'une des rares réactions non radicalaires des alcanes, qui se produit en catalyse fortement acide (acide sulfurique, acide fluorhydrique anhydre) [réactions 2]. L' isobutène (I) est transformé par l'acide fluorhydrique en fluorure du cation triméthylcarbénium (II). Ce dernier arrache un ion hydrure à l'alcane ramifié (III), le transformant lui-même en cation carbénium (IV) qui attaque une seconde molécule d'isobutène (I) en formant un nouvel ion carbénium (V). Celui-ci, jouant le même rôle que le cation triméthylcarbénium (II), donne l'alcane ramifié de condensation (VI) en régénérant le carbénium (IV) : c'est une réaction en chaîne [...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Médias
Autres références
-
ALCÈNES ou OLÉFINES
- Écrit par Jacques METZGER
- 3 642 mots
- 4 médias
Certains alcanes ramifiés s'additionnent sur les alcènes, eux-mêmes ramifiés, en présence de catalyseurs acides. L'industrie du raffinage pratique cette réaction en alkylant l'isobutène par des alcanes tertiaires. -
CHIMIE - La nomenclature chimique
- Écrit par Nicole J. MOREAU
- 5 031 mots
- 7 médias
Les alcanes sont des hydrocarbures acycliques de formule générale CnH2n+2, où la chaîne carbonée peut être linéaire ou ramifiée. Une chaîne linéaire est composée de groupes –CH2- avec deux groupes CH3 terminaux, alors qu'une chaîne ramifiée possède au moins un atome de carbone lié à plus... -
CYCLANES & CYCLÈNES
- Écrit par Jean-Marie CONIA
- 1 908 mots
- 7 médias
Les cyclanes (ou cyclo- alcanes) sont des hydrocarbures comportant un ou plusieurs cycles d'atomes de carbone unis par des liaisons simples. Les cyclanes simples, non substitués, de formule générale (CH2)n constituent une série homologue particulièrement intéressante, car leurs synthèses et...
-
HALOGÈNES
- Écrit par Jacques METZGER et Robert de PAPE
- 6 602 mots
- 5 médias
- Afficher les 7 références