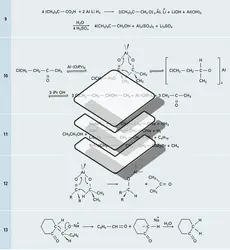
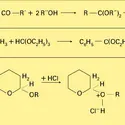
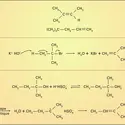
ALCOOLS
Article modifié le
Propriétés physiques
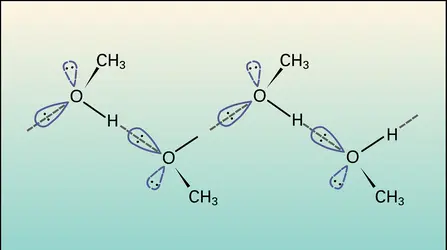
La présence de la fonction hydroxyle entraîne, pour les alcools, un ensemble de propriétés physiques particulières : les molécules sont polaires et associées par des liaisons hydrogène. Surtout sensible pour les premiers termes, cette association intermoléculaire se traduit par un ensemble de propriétés caractéristiques. Moins spectaculaire que pour l'eau, bien que de même nature, elle est importante pour les alcools primaires, notable pour les secondaires et faible pour les tertiaires. Elle diminue lorsque la température s'élève.
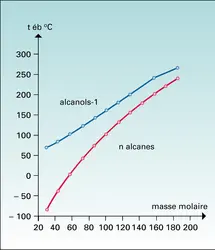
Une première conséquence de cette association est une température d'ébullition des alcools notablement supérieure à celle des alcanes de même masse moléculaire, avec une anomalie dans l'évolution de la volatilité des alcools primaires linéaires : alors que dans la série des n-alcanes (liquides idéaux) l'écart entre les températures d'ébullition de deux homologues consécutifs diminue lorsque la chaîne s'allonge, dans le cas des alcools cet écart, du moins jusqu'au terme en C10, est sensiblement constant et voisin de 19 0C. Cette anomalie résulte d'une compensation, presque rigoureuse, entre l'effet de l'allongement de la chaîne et la diminution de l'association avec l'élévation de la température. Cette association explique l'écart notable des températures d'ébullition d'alcools primaires, secondaires et tertiaires isomères ainsi que la proximité de celles des alcools C2 primaire, C3 secondaire et C4 tertiaire.
L'affinité pour l'eau des alcools, notamment des premiers termes, entraîne l'existence d'une azéotropie homogène ou hétérogène, mais toujours positive. L'azéotrope eau-éthanol bout seulement à 0,25 0C plus bas que l'éthanol pur (respectivement 78,15 0C et 78,40 0C) ; il renferme environ 5 p. 100 d'eau en poids et est désigné sous le nom d'alcool à 95o. Le pourcentage d'eau dans les azéotropes augmente avec la masse moléculaire de l'alcool.
Les températures de fusion des alcools ne présentent pas de loi simple d'évolution en fonction de la masse moléculaire, du moins pour les premiers termes. Pour les alcools primaires linéaires plus longs, on observe une progression voisine de celle observée pour les alcanes de même chaîne. Les alcools tertiaires symétriques cristallisent plus facilement que leurs isomères primaires et secondaires. Par exemple, le butanol tertiaire fond à 25,5 0C, alors que les isomères n-primaire, iso-primaire, secondaire fondent respectivement à − 79,9 0C, − 108 0C et − 114,7 0C. De nombreux alcools naturels, appartenant à la série terpénique, sont solides à la température ordinaire (l(−) menthol F 43 0C ; d,l bornéol F 208 0C).
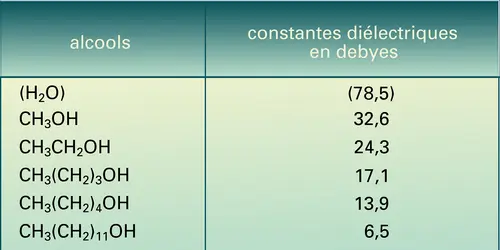
Du fait de leur constante diélectrique relativement élevée, les alcools en C1, C2 et C3 sont des solvants protoniques polaires pour les espèces ioniques. Leur capacité de former des associations par liaison hydrogène leur permet aussi de dissoudre des molécules à caractère acide et basique ; c'est pourquoi ils sont couramment employés en synthèse organique. Ils sont, ainsi que le tertiobutanol, miscibles à l'eau en toute proportion. Les autres butanols restent solubles mais non miscibles, et la solubilité dans l'eau diminue lorsque la masse moléculaire augmente, puis elle devient négligeable à partir de C10 ; en revanche, la liposolubilité augmente.
Les termes simples tels que le méthanol et l'éthanol dissolvent facilement certains sels de métaux à caractère faiblement ionique : halogénures de lithium, chlorure mercurique, chlorure ferrique ; ces solutions ne sont pas ionisées. Les sels à caractère ionique ont une solubilité variable en fonction de leur nature : les chlorures de sodium et de potassium sont très peu solubles, les iodures et les nitrites le sont ; ces solutions restent peu ionisées et renferment vraisemblablement des paires d'ions solvatées. La soude et la potasse se dissolvent aisément alors que la baryte Ba(OH)2, les sulfates et carbonates sont totalement insolubles. L'éthanol, en particulier, est souvent utilisé pour éliminer l'un de ces sels d'une préparation organique. Les sucres sont bien moins solubles dans l'éthanol que dans l'eau.
Transparents dans l'ultraviolet et le visible, les alcools présentent, en absorption infrarouge, des bandes caractéristiques de la vibration d'élongation de la liaison O−H. Lorsque l'éthanol est en phase vapeur ou en solution très diluée dans un solvant apolaire comme CCl4, la bande νO-H est fine et située à 3 650 cm-1 : la molécule n'est pas associée. Si la concentration augmente, et a fortiori pour l'alcool pur, une seconde bande large apparaît autour de 3 350 cm-1 qui correspond à la vibration d'élongation de la liaison O−H de molécules associées par liaison hydrogène. L'apparition de cette bande à environ 300 cm-1 vers les basses fréquences correspond à un « alourdissement » de l'atome d'hydrogène, et son élargissement au fait que les molécules d'alcool sont associées en agrégats de taille et de forme variables, correspondant à des liaisons hydrogène de nature variée, dont les fréquences de vibration se situent dans un intervalle de plusieurs centaines de cm-1 autour d'une valeur centrale de 3 350 cm-1. De l'intensité relative des bandes νO-H libre et νO-H associé, on peut estimer le degré d'association de l'alcool.
Les propriétés organoleptiques et physiologiques des alcools varient avec leur nature. Le méthanol, l'éthanol et l'isopropanol, bien purs, sont à peu près inodores ; les deux derniers, l'éthanol surtout, sont les excipients les plus courants des parfums naturels ou synthétiques. Les alcools tertiaires simples possèdent une odeur camphrée. Les premiers termes des alcools éthyléniques sont agressifs. Par contre, parmi les termes moyens se rencontrent de nombreux parfums naturels ou artificiels : géraniol, linalol, citronellol, bornéol, etc.. Ils sont utilisés en parfumerie ainsi que leurs esters.
À des doses raisonnables, l'éthanol, présent dans les vins, cidres, poirés, bières, etc., et dans les spiritueux, n'est pas toxique ; sa valeur stimulative est très contestée. À haute dose, il provoque l'ivresse ; à dose exagérée et répétée, l'alcoolisme et la cirrhose. Toutefois, il est bien établi que les effets durables qu'on lui attribue sont dus en partie aux impuretés qui l'accompagnent dans les spiritueux : alcools supérieurs, aldéhydes ou cétones auxquels ils doivent leur arôme.
Le méthanol, parfois employé dans la confection frauduleuse des spiritueux, est beaucoup plus toxique. On lui doit de nombreux accidents mortels et des cas de cécité. Les alcools dit de « fusel », alcools supérieurs de fermentation, présents dans les eaux-de-vie mal rectifiées, sont également dangereux.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Médias
Autres références
-
ACÉTALS
- Écrit par Jacques METZGER
- 866 mots
- 1 média
Les acétals sont les composés gem-dialcoxylés c'est-à-dire qui portent sur le même atome de carbone tétracoordiné de la chaîne deux fonction éther-oxyde. Ils dérivent formellement de l'élimination d'une molécule d'eau entre un dérivé carbonylé et deux molécules d'alcool (réaction 1). On distingue...
-
ACIDES-ALCOOLS
- Écrit par Jacques METZGER
- 1 300 mots
- 1 média
Un acide-alcool est une molécule renfermant au moins une fonction acide carboxylique et une fonction alcool.
La nature nous en fournit de nombreux exemples : acides lactique du lait aigri, malique des pommes avant maturité (diacide-monoalcool), tartrique du tartre des vins (diacide-diacool), citrique...
-
ALCÈNES ou OLÉFINES
- Écrit par Jacques METZGER
- 3 642 mots
- 4 médias
Lesalcools tertiaires sont facilement déshydratés par un chauffage modéré en présence d'un catalyseur acide fort. Le mécanisme de cette élimination est normalement unimoléculaire E1 : le catalyseur acide transforme le mauvais groupe partant HO- en bon groupe partant H2O et permet ainsi... -
ALCOOL ÉTHYLIQUE ou ÉTHANOL
- Écrit par Fernand COUSSEMANT
- 694 mots
Alcool primaire, liquide incolore, d'odeur agréable, miscible à l'eau en toutes proportions, miscible à de nombreux solvants organiques, l'éthanol ou alcool éthylique, CH3—CH2OH, a les caractéristiques suivantes :
Masse moléculaire : 46,07 g
Masse spécifique : 0,789 3...
- Afficher les 20 références
Voir aussi
- HYDROLYSE
- HYDROGÈNE LIAISON
- ORGANOMAGNÉSIENS COMPOSÉS
- SOLUBILITÉ
- HYDROXYLE ou OXHYDRYLE
- HYDRATATION
- HYDROGÉNATION
- CÉTONES
- ADDITION, chimie
- DÉSHYDROGÉNATION
- ALDÉHYDES
- POLARISATION, chimie
- OXYDATION
- DÉSHYDRATATION
- CONSTANTE DIÉLECTRIQUE
- SAPONIFICATION
- ESTÉRIFICATION
- ALCOOLYSE
- MEERWEIN-PONNDORF-VERLEY RÉACTION DE
- BOUVEAULT & BLANC RÉACTION DE
- ALCOOLATES
- ÉLECTRONIQUE STRUCTURE
- NOMENCLATURE, chimie
- RÉDUCTION, chimie
- BUTANOL
- ISOPROPANOL
- ALCOOLIQUE FERMENTATION
- TEMPÉRATURE D'ÉBULLITION
- HALOGÉNURES D'ALKYLE
- HYDROFORMYLATION ou RÉACTION OXO