ALCOOLS
Article modifié le
Propriétés chimiques
Structure électronique
Compte tenu de la grande électronégativité de l'oxygène, la molécule d'alcool connaît, au niveau du groupe fonctionnel, une importante polarisation des liaisons C −>− O et O −<− H. Celle-ci induit, dans le squelette hydrocarboné, une polarisation monotone des liaisons adjacentes, qui s'amortit dès la troisième liaison (effet induit ou effet de champ). Les réponses, à cette induction, des liaisons issues du carbone sp3 porteur du groupe OH, sont différentes en fonction du degré de substitution de cet atome : en effet, le carbone sp3 des alcanes est moins électronégatif que l'hydrogène, de sorte que la liaison C(sp3)−H est naturellement polarisée du carbone (δ+) vers l'hydrogène (δ-). La situation électronique des alcools dépend ainsi de leur classe, l'effet de champ de l'oxygène fonctionnel étant mieux relayé par la chaîne carbonée d'un alcool tertiaire que par celle d'un primaire.
Réactions mettant en jeu la liaison OH
Acidité, basicité
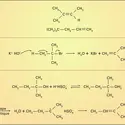
La fonction alcool présente à la fois un caractère acide et un caractère basique. Son acidité se manifeste lorsqu'il est mis au contact d'une base : le proton est cédé à cette dernière et l'anion alcoolate formé ainsi que l'acide conjugué de la base se trouvent en équilibre avec l'alcool non dissocié :
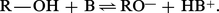
La basicité de l'alcool se manifeste lorsqu'il est mis en présence d'un acide protonique : il fixe le proton de ce dernier, et le cation alkyloxonium formé, ainsi que la base conjuguée de l'acide se trouvent en équilibre avec l'alcool non protoné :
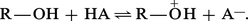
Étant à la fois acide et base, l'alcool pur se trouve en équilibre avec son acide et sa base conjugués :
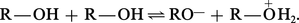
Cet équilibre d'autodissociation de l'alcool est très déplacé vers la gauche, plus encore que celui de l'eau : le produit ionique du méthanol est de 10-17, alors que celui de l'eau est de 10-14.
En solution dans l'eau, les alcools sont donc faiblement dissociés selon l'équilibre :
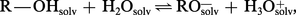
Cette plus forte acidité des alcools primaires résulte de la meilleure dispersion de la charge négative de l'anion alcoolate sur le squelette hydrocarboné, qui entraîne une meilleure solvatation de cet anion.
La basicité des alcools est légèrement inférieure à celle de l'eau, et l'acide conjugué de l'alcool est d'autant mieux stabilisé par solvatation que sa charge positive est mieux dispersée sur le squelette hydrocarboné, ce qui entraîne une basicité décroissante dans l'ordre : alcool tertiaire > secondaire > primaire > méthanol.
Formation et réactions d'alcoolates
Les dérivés métalliques d'acides plus faibles que les alcools réagissent avec ces derniers en formant des alcoolates : l'amidure de sodium, l'hydrure de sodium, le butyllithium et le bromure de méthylmagnésium réagissent avec l'éthanol en formant, d'une manière pratiquement totale, l'éthylate métallique correspondant (réactions 11).
Les métaux alcalins, l'aluminium amalgamé réagissent sur les alcools en formant les alcoolates métalliques correspondants, avec dégagement d'hydrogène :
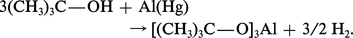
Les alcoolates d'aluminium et de magnésium ne sont pas ionisés en solution alcoolique, les alcoolates alcalins le sont partiellement (paires d'ions solvatées). Ce sont des bases relativement fortes qui sont utilisées comme catalyseurs dans de nombreuses réactions. Les alcoolates sont complètement hydrolysés si l'eau est en grand excès ; en proportions stœchiométriques, l'hydrolyse de l'éthylate de sodium est limitée à 70 p. 100, ce qui permet la fabrication de l'éthylate de sodium à partir de l'alcool absolu en grand excès et de la soude :

Les alcoolates sont des réactifs meilleurs nucléophiles que les alcools, ils interviennent dans des réactions d'éthérification. Agissant sur un halogénure, un sulfonate ou un sulfate d'alkyle, ils conduisent aux éthers (Williamson, 1850). La réaction de substitution SN2 est beaucoup plus rapide que celle des alcools correspondants ; elle peut être accompagnée d'une élimination E2 conduisant aux alcènes. Cette réaction secondaire est d'autant plus probable que l'alcool est tertiaire et que la température de réaction est élevée :

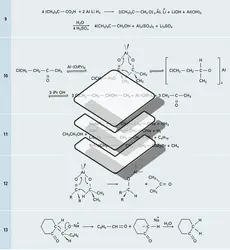
Les alcoolates primaires et secondaires sont également des réducteurs, comme dans l'échange fonctionnel alcool/aldéhyde-cétone catalysé par l'isopropylate d'aluminium : c'est la réduction de Meerwein-Ponndorf-Verley (réaction 10). Ce mécanisme fait intervenir un transfert d'hydrure dont le moteur est le passage du doublet libre de la fonction alcoolate en doublet π carbonyle (réaction 12).
Les alcoolates métalliques qui dérivent d'alcools porteurs en β d'un groupe susceptible de stabiliser un carbanion (〉 C=O, −CO2R, −NO2, −SO2) subissent plus ou moins facilement la fragmentation conduisant à ce dernier sous l'action d'une élévation de température (réaction 13).
Estérification
Bien que plusieurs mécanismes entrent en action dans l'estérification des acides carboxyliques par les alcools, le plus important d'entre eux fait intervenir la rupture de la liaison O−H. Cette réaction, très lente en l'absence de catalyseur, est fortement accélérée par les ions H+ ; sa limite à l'équilibre dépend de la classe de l'alcool : à partir d'un mélange stœchiométrique d'acide carboxylique et d'alcool, elle atteint 73 p. 100 pour le méthanol, 66 p. 100 pour les alcools primaires, 63 p. 100 pour les secondaires et moins de 10 p. 100 pour les tertiaires.
Le mécanisme le plus important correspond à l'activation nucléophile de l'acide par protonation, attaque de l'acide activé par l'alcool dans une étape d'addition nucléophile, trans-protonation suivie de l'élimination intramoléculaire du bon groupe partant H2O (réaction 14). Cette réaction d'estérification, réalisée avec un diacide et un glycol primaire, conduit aux polyesters utilisés pour la fabrication de fibres, de films, de résines :

Dans le cas d'un alcool tertiaire, un mécanisme différent fait intervenir la rupture de la liaison C−O. Étant plus basique, il se protone et subit une hétérolyse unimoléculaire qui conduit à un cation carbénium tertiaire. Ce dernier, fortement électrophile, attaque l'acide carboxylique pour former l'ester :

Les chlorures d'acides et les anhydrides d'acides réagissent plus rapidement avec les alcools primaires et secondaires en formant des esters :

Dans le cas des alcools tertiaires, il peut se produire une réaction parallèle de chloruration. Les acides minéraux faibles comme B(OH)3, HNO2 réagissent d'une manière analogue avec les alcools primaires ; la réaction est également réversible.
Réactions d'addition
Les alcools s'additionnent aux composés insaturés polaires, l'oxygène jouant le rôle d'un nucléophile et l'hydrogène celui d'un électrophile.
Les dérivés carbonylés, aldéhydes et cétones additionnent les alcools primaires, en catalyse acide, pour donner des acétals :

Les époxydes réagissent, en catalyse acide, avec les alcools primaires en formant des éthers de glycols :

Les isocyanates forment, avec les alcools primaires, des carbamates appelés uréthannes : cette réaction est utilisée pour l'identification des alcools par la détermination de la température de fusion du phényluréthanne. Ce dernier, qui est un solide bien cristallisé, résulte de l'addition de l'alcool à l'isocyanate de phényle (réaction 15). La polyaddition d'un di-isocyanate à un glycol primaire ou secondaire conduit à un polyuréthanne qui est un polymère aux multiples usages : mousses souples, objets moulés, vernis polymérisables.
Réactions mettant en jeu la liaison C−O
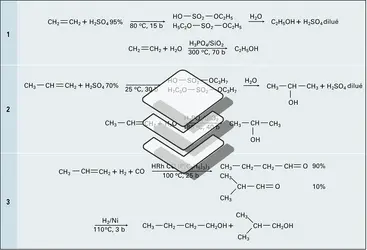
Les acides halogénés attaquent les alcools en formant réversiblement des halogénures d'alkyle. Les réarrangements de Wagner-Meerwein du squelette carboné peuvent se produire chez les alcools tertiaires encombrés en α de la fonction. Dans le cas des alcools tertiaires, secondaires ou αβ insaturés, le mécanisme est normalement unimoléculaire (SN1) et fait intervenir un cation carbénium ; ce dernier peut se réarranger en formant un cation plus stable ou, s'il est allylique, il offre au nucléophile halogénure plusieurs sites réactionnels. La bromuration du méthyltertiobutylcarbinol donne exclusivement le bromure de diméthylisopropylcarbinyle (réaction 16). De même, la chloruration du méthylvinylcarbinol conduit à un mélange des trois chlorures allyliques isomères (réaction 17). L'acide chlorhydrique, moins réactif que les acides bromhydrique et iodhydrique, peut être activé par un acide de Lewis comme ZnCl2. La réaction de ce superacide, avec les alcools, permet de déterminer leur classe : à température ordinaire, l'alcool tertiaire réagit très rapidement, le secondaire demande plusieurs minutes et le primaire nécessite un chauffage (test de Lucas).
Les oxacides forts comme H2SO4, NHO3 forment réversiblement à froid des esters avec les alcools primaires à température modérée (< 130 0C). En présence d'un excès d'alcool, l'ester sulfurique formé est alcoolysé en éther ; à température plus élevée (150 0C), il subit une élimination qui conduit à l'alcène. Les alcools tertiaires subissent essentiellement une déshydratation :

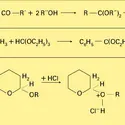
Les chlorures d'acides carboxyliques réagissent avec les alcools tertiaires en donnant simultanément un ester et un chlorure. L'attaque nucléophile de la fonction carbonyle, par l'alcool, aboutit à un intermédiaire qui peut soit éliminer un proton et conduire à l'ester, soit subir une hétérolyse formant un cation carbénium tertiaire et aboutir au chlorure d'alkyle (réaction 18).
Les chlorures d'acides minéraux, comme l'oxychlorure de phosphore OPCl3 et le chlorure de thionyle OSCl2, transforment les alcools en chlorure d'alkyle. Dans le cas du chlorure de thionyle, la réaction est stéréospécifique et se produit avec rétention de configuration ; le chlorosulfite d'alkyle formé initialement se fragmente selon un mécanisme SN1 de substitution nucléophile interne (réaction 19).
L'élimination d'une molécule d'eau (déshydratation) se produit très rapidement, en catalyse acide et à température modérée, pour des alcools tertiaires ; elle est plus lente pour les secondaires et nécessite, pour les primaires, une température plus élevée (150 0C). La plupart des alcools se déshydratent à une température supérieure à 300 0C, en présence de catalyseurs solides comme la silice ou l'alumine, en donnant des alcènes, accompagnés parfois d'éthers si la température est plus modérée.
Réactions de déshydrogénation et d'oxydation
Le méthanol, les alcools primaires et secondaires subissent une déshydrogénation sous l'action de catalyseurs comme le nickel, le platine, le cuivre réduits. Cette réaction, réalisée en phase gazeuse, est réversible. On peut la rendre totale en la combinant à une oxydation ménagée par l'air. Il se forme un dérivé carbonylé : le méthanal dans le cas du méthanol, un aldéhyde dans le cas d'un alcool primaire, une cétone dans celui d'un alcool secondaire (réactions 20). Les alcools tertiaires ne possédant pas d'hydrogène sur le carbone porteur de la fonction ne subissent pas de déshydrogénation, tout au plus sont-ils déshydratés en alcènes dans les mêmes conditions. Le méthanal est fabriqué industriellement par oxydéshydrogénation du méthanol par un défaut d'air sur catalyseur d'argent à 680 0C. Un procédé de fabrication de l'éthanal réalise la déshydrogénation de l'éthanol sur catalyseur au cuivre, activé par le zinc, à 280 0C.
Le passage de l'alcool au dérivé carbonylé peut être réalisé à froid par oxydation en phase liquide. L'oxydant usuel est l'acide chromique H2CrO4 ou le bichromate de sodium Na2Cr2O7 et l'acide sulfurique. Le mécanisme de cette réaction fait intervenir la formation d'un chromate d'alkyle suivie d'une élimination inter ou intramoléculaire au cours de laquelle le chrome subit une réduction du degré d'oxydation 6(H2CrO4) au degré d'oxydation 4(H2CrO3) qui se dismute en donnant du chrome III et du chrome VI (réactions 21). Dans ces conditions, l'aldéhyde résultant de l'oxydation d'un alcool primaire est distillé au fur et à mesure de sa formation pour éviter une oxydation ultérieure en acide.
Vis-à-vis d'oxydants plus puissants comme le permanganate de potassium ou l'acide nitrique à 80 0C, les trois classes d'alcool réagissent spécifiquement. Les alcools primaires sont transformés en acide à même nombre d'atomes de carbone ; en effet, la plupart des acides sont inoxydables dans ces conditions. Les alcools secondaires sont oxydés en cétones qui, si on insiste, subissent une rupture oxydante en un mélange d'acides et éventuellement de cétones peu oxydables ; l'acétone résiste à cette oxydation ultérieure.
Les résultats sont plus complexes si les radicaux qui flanquent le groupe −CHOH− sont ramifiés ; seul l'isopropanol n'est pas dégradé. Les alcools tertiaires sont peu oxydables en milieu neutre ; en milieu acide, seuls les alcools non déshydratables, comme (C6H5)3COH, résistent aux oxydants. Les autres sont déshydratés sous l'action catalytique de l'acide, et l'alcène résultant est très oxydable. Il se forme un glycol qui subit un clivage oxydant (réaction 22).
Une oxydation sélective des alcools primaires et secondaires peut être réalisée par un échange fonctionnel catalysé par le tertiobutylate d'aluminium. C'est la réaction d'Oppenauer, inverse de la réaction de Meerwein-Ponndorf-Verley (réaction 10) ; l'alcool à oxyder est mis en présence d'un large excès d'acétone (rapport molaire 1/50) et du catalyseur. L'équilibre ainsi déplacé par action de masse permet la transformation, pratiquement totale, de l'alcool en aldéhyde ou cétone.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Médias
Autres références
-
ACÉTALS
- Écrit par Jacques METZGER
- 866 mots
- 1 média
Les acétals sont les composés gem-dialcoxylés c'est-à-dire qui portent sur le même atome de carbone tétracoordiné de la chaîne deux fonction éther-oxyde. Ils dérivent formellement de l'élimination d'une molécule d'eau entre un dérivé carbonylé et deux molécules d'alcool (réaction 1). On distingue...
-
ACIDES-ALCOOLS
- Écrit par Jacques METZGER
- 1 300 mots
- 1 média
Un acide-alcool est une molécule renfermant au moins une fonction acide carboxylique et une fonction alcool.
La nature nous en fournit de nombreux exemples : acides lactique du lait aigri, malique des pommes avant maturité (diacide-monoalcool), tartrique du tartre des vins (diacide-diacool), citrique...
-
ALCÈNES ou OLÉFINES
- Écrit par Jacques METZGER
- 3 642 mots
- 4 médias
Lesalcools tertiaires sont facilement déshydratés par un chauffage modéré en présence d'un catalyseur acide fort. Le mécanisme de cette élimination est normalement unimoléculaire E1 : le catalyseur acide transforme le mauvais groupe partant HO- en bon groupe partant H2O et permet ainsi... -
ALCOOL ÉTHYLIQUE ou ÉTHANOL
- Écrit par Fernand COUSSEMANT
- 694 mots
Alcool primaire, liquide incolore, d'odeur agréable, miscible à l'eau en toutes proportions, miscible à de nombreux solvants organiques, l'éthanol ou alcool éthylique, CH3—CH2OH, a les caractéristiques suivantes :
Masse moléculaire : 46,07 g
Masse spécifique : 0,789 3...
- Afficher les 20 références
Voir aussi
- HYDROLYSE
- HYDROGÈNE LIAISON
- ORGANOMAGNÉSIENS COMPOSÉS
- SOLUBILITÉ
- HYDROXYLE ou OXHYDRYLE
- HYDRATATION
- HYDROGÉNATION
- CÉTONES
- ADDITION, chimie
- DÉSHYDROGÉNATION
- ALDÉHYDES
- POLARISATION, chimie
- OXYDATION
- DÉSHYDRATATION
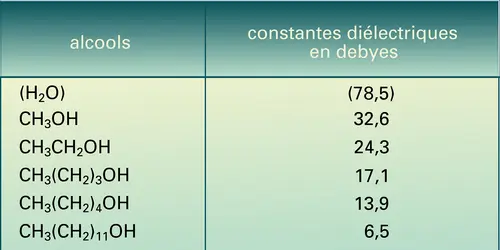
- CONSTANTE DIÉLECTRIQUE
- SAPONIFICATION
- ESTÉRIFICATION
- ALCOOLYSE
- MEERWEIN-PONNDORF-VERLEY RÉACTION DE
- BOUVEAULT & BLANC RÉACTION DE
- ALCOOLATES
- ÉLECTRONIQUE STRUCTURE
- NOMENCLATURE, chimie
- RÉDUCTION, chimie
- BUTANOL
- ISOPROPANOL
- ALCOOLIQUE FERMENTATION
- TEMPÉRATURE D'ÉBULLITION
- HALOGÉNURES D'ALKYLE
- HYDROFORMYLATION ou RÉACTION OXO