ALDÉHYDES ET CÉTONES
Article modifié le
Propriétés chimiques
Réactivité. Les propriétés chimiques des dérivés carbonylés sont caractérisées par l'insaturation de la fonction carbonyle, par la forte polarisation de la liaison C − O et sa transmission au niveau des atomes de carbone en α ; pour les aldéhydes, l'hydrogène porté par le carbone fonctionnel présente des propriétés particulières.
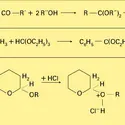
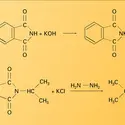
Insaturation et polarisation de la fonction carbonyle. L'insaturation donne lieu à des réactions d'addition, et la polarisation oriente la fixation du nucléophile sur le carbone et celle de l'électrophile sur l'oxygène. Lorsque le réactif nucléophile est de forme Nu − H et présente une acidité suffisante, l'addition procède par une protonation de l'oxygène, suivie de son attaque sur le carbone ; dans le cas le plus général, cette attaque précède celle de l'électrophile. Une grande variété de molécules nucléophiles peut ainsi réagir en addition sur les aldéhydes et les cétones, introduisant sur le carbone fonctionnel soit une nouvelle fonction (halogénée, oxygénée, sulfurée, azotée...), soit un nouveau groupe carboné, soit un hydrogène. La stéréochimie de l'addition est définie par le maximum du recouvrement entre l'orbitale décrivant le doublet du nucléophile et l'orbitale π* (antiliante) de la liaison carbonyle, c'est-à-dire que l'attaque du carbone fonctionnel se fait selon une direction presque perpendiculaire au plan de la molécule, formant avec celle de la liaison σCO un angle un peu supérieur à 900. Il résulte de cette géométrie de l'état de transition que l'interaction stérique entre le nucléophile et le squelette carboné est plus importante dans le cas d'une cétone que dans celui d'un aldéhyde, et, de ce fait, la vitesse de la réaction (ou l'équilibre, si elle est réversible) est généralement la plus grande dans le cas des aldéhydes. Ces réactions d'addition nucléophile sont catalysées par les acides qui, par fixation sur l'oxygène, activent le substrat carbonylé ; elles le sont également par les bases, lorsque le nucléophile peut ainsi être transformé en sa base conjuguée, plus réactive (réaction).
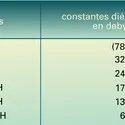
Acidité de la fonction carbonyle. Dans les dérivés carbonylés, les hydrogènes portés par les carbones adjacents au carbone fonctionnel ont une acidité relativement importante. Le pKa du pseudo-acide correspondant est de l'ordre de 19 - 20 (les autres hydrogènes de la chaîne correspondent à des pKa de 40 à 50). Parallèlement, l'oxygène fonctionnel est basique (son acide conjugué à un pKa de − 7 pour les cétones, et de − 10 pour les aldéhydes). Entre les deux centres se produit un échange réversible de proton, qui est à l'origine de l'équilibre protomère (céto-énolique) entre les formes cétone (ou aldéhyde) et énol (réaction). La constante de cet équilibre est élevée pour les premiers termes de la série des aldéhydes, elle est un peu moins importante pour les cétones. Néanmoins, s'agissant d'un équilibre, et compte tenu du fait que ces formes énoliques sont hautement réactives, de nombreuses réactions du groupe carbonyle, faisant intervenir le (ou les) atome(s) d'hydrogène en α, sont limitées aux seuls aldéhydes et cétones énolisables. L' énolisation se produit spontanément, elle est néanmoins accélérée par les acides et les bases (réaction). L'énol, comme sa base conjuguée énolate, est une espèce nucléophile ambidente susceptible de réagir, soit au niveau du carbone (réactifs mous), soit au niveau de l'oxygène (réactifs durs) : c'est ainsi que la protonation de l'anion énolate se produit préférentiellement au niveau de l'oxygène et conduit normalement à l'énol, tandis que sa réaction avec un centre électrophile mou (halogénure d'alkyle...) se produit préférentiellement au niveau du carbone (réaction). De très nombreuses réactions font intervenir aldéhydes[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Médias
Autres références
-
ACÉTALS
- Écrit par Jacques METZGER
- 866 mots
- 1 média
Les acétals sont les composés gem-dialcoxylés c'est-à-dire qui portent sur le même atome de carbone tétracoordiné de la chaîne deux fonction éther-oxyde. Ils dérivent formellement de l'élimination d'une molécule d'eau entre un dérivé carbonylé et deux molécules d'alcool (réaction 1). On distingue...
-
ALCOOLS
- Écrit par Jacques METZGER
- 5 834 mots
- 8 médias
La réduction des aldéhydes et des cétones en alcools primaires et secondaires peut être réalisée par l'action de l'hydrogène en présence de catalyseur métallique comme le platine Pt et le nickel Ni :
-
ALDOLS & CÉTOLS
- Écrit par Jacques METZGER
- 1 406 mots
- 3 médias
Aldols et cétols sont les composés dont la chaîne hydrocarbonée porte à la fois une fonction alcool et une fonction carbonyle, aldéhyde ou cétone.
C'est Charles Adolphe Wurtz qui a donné le nom d'aldol (de aldéhyde-alcool) au composé résultant de la dimérisation de l'acétaldéhyde...
-
AMINES
- Écrit par Jacques METZGER
- 3 235 mots
- 4 médias
Addition sur les aldéhydes et les cétones : les amines primaires forment un hémiaminal qui se déshydrate facilement en donnant une aldimine ou une cétimine. Les amines secondaires forment également un hémiaminal dont la déshydratation conduit à une énamine, l'élimination de l'eau se faisant par... - Afficher les 8 références
Voir aussi
- POLYMÉRISATION
- PERKIN RÉACTION DE
- ORGANOMAGNÉSIENS COMPOSÉS
- HYDRURES
- HALOGÉNÉS DÉRIVÉS
- HYDRATATION
- HYDROGÉNATION
- CYCLOHEXANONES
- CÉTONES
- ADDITION, chimie
- ALKYLATION ou ALCOYLATION
- ACYLATION
- ALDÉHYDES
- ACÉTYLURES
- FRIEDEL & CRAFTS RÉACTIONS DE
- POLARISATION, chimie
- OXYDATION
- SCHIFF BASES DE
- ALDOLISATION
- CÉTOLISATION
- ORGANOZINCIQUES COMPOSÉS
- HALOGÉNATION
- PALLADIUM
- REIMER & TIEMANN RÉACTION DE
- REFORMATSKY RÉACTION DE
- ÉNOLS
- ANHYDRIDE ACÉTIQUE
- TISCHTENKO RÉACTION DE
- CROTONISATION
- ÉNOLISATION
- CANNIZZARO RÉACTION DE
- ÉLECTRONIQUE STRUCTURE
- MERCAPTANS ou THIOLS
- CHLOROFORME
- NOMENCLATURE, chimie
- RÉDUCTION, chimie
- CYANHYDRIQUE ACIDE
- PARFUMS INDUSTRIE DES
- FORMOL
- RÉACTIVITÉ CHIMIQUE
- RACÉMISATION
- HYDROFORMYLATION ou RÉACTION OXO