ALDOLS & CÉTOLS
Article modifié le
Propriétés
Les aldols et les cétols sont des liquides visqueux dont les premiers termes sont solubles dans l'eau. Ils sont à peine distillables sous pression réduite sans décomposition.
Les α-cétols, notamment les acyloïnes, se dimérisent réversiblement (hémiacétalisation) en dioxannes-1,4 instables (réaction 4). Ils réagissent avec l'urée pour former des imidazolinones-2 (réaction 5). Ce sont des réducteurs comme le montre leur action sur le nitrate d'argent ammoniacal et la liqueur de Fehling ; ils sont facilement oxydés en α-dicétones (réaction 6). L'acide métapériodique les scinde en un aldéhyde et un acide :
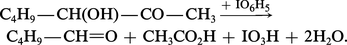
En milieu alcalin, les α-aldols s'isomérisent réversiblement en α-cétols, par l'intermédiaire d'un énediol :
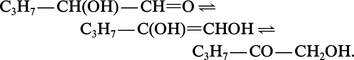
Le β-aldol de Wurtz est trimérisé à froid par l'acide sulfurique concentré en paraldol. Ce polymère, cristallisé, est sous sa forme de conservation ; il se comporte, vis-à-vis des acides, comme le monomère.
Une propriété importante, commune aux β-aldols et β-cétols, est leur facile déshydratation par chauffage, en catalyse acide. L'aldéhyde ou la cétone α-éthylénique qui en résultent sont stabilisés par la conjugaison. L'aldol de Wurtz se déshydrate par simple chauffage, en présence d'une petite quantité d'acide acétique, pour former l'aldéhyde crotonique, mélange d'isomères E et Z, qui a donné son nom à l'ensemble des deux réactions d'aldolisation et d'élimination qui est appelé crotonisation :
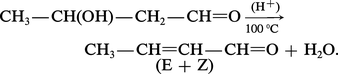
La crotonisation des β-cétols se produit encore plus facilement lorsque la fonction alcool est tertiaire : le diacétone alcool, chauffé en présence d'une trace d'acide sulfurique, donne la cétone α-éthylénique, appelée improprement oxyde de mésityle, mélange de deux isomères dans lequel la forme conjuguée prédomine largement (réaction 7).
L'oxyde de mésityle est un intermédiaire industriel important, qui, par hydrogénation sur palladium, conduit à la méthylisobutylcétone et, sur nickel à 150 0C, au méthylisobutylcarbinol. Ces deux produits sont des solvants de l'industrie des peintures (réactions 8).
La double crotonisation de l'acétone est réalisée par simple chauffage en présence d'acide chlorhydrique sec ; la cétone α-, α′-diéthylénique obtenue est encore appelée phorone (réaction 9).
Par chauffage prolongé à 200 0C, sous pression, de l'acétone en présence d'une faible quantité de soude, il se forme successivement le diacétone alcool qui se déshydrate en oxyde de mésityle ; celui-là réagit, dans une addition de Michael, avec une troisième molécule d'acétone (énolate) pour donner une 3,5,5-triméthylcyclohexène-2-one, isomère cyclique de la phorone et appelée isophorone (réaction 10).
Un important alcool primaire industriel, le 2-éthylhexanol, est fabriqué par hydrogénation du 2-éthylhexèn-2-al, lui-même obtenu par crotonisation du butanal (réaction 11).
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Médias
Autres références
-
ALDÉHYDES ET CÉTONES
- Écrit par Jacques METZGER
- 7 356 mots
- 4 médias
Aldolisation.Les aldéhydes énolisables, c'est-à-dire qui possèdent un atome d'hydrogène sur le carbone en α du groupe carbonyle, se dimérisent sous l'influence catalytique de bases ou d'acides (soude diluée, carbonate de sodium, cyanure alcalin, acétate de sodium ou acide chlorhydrique ou sulfurique... -
ÉTHANAL ou ACÉTALDÉHYDE ou ALDÉHYDE ACÉTIQUE
- Écrit par Dina SURDIN
- 453 mots
Appelé parfois improprement acétaldéhyde, aldéhyde acétique
ou aldéhyde éthylique
CH3—CHO
Masse moléculaire : 44,05 g
Point d'ébullition : + 21 0C
Liquide incolore, inflammable, à odeur caractéristique, infiniment soluble dans l'eau, l'éthanol, l'éther, le ...
Voir aussi