AMINES
Propriétés chimiques des amines aliphatiques
La chimie des trois classes d'amines est caractérisée par la présence, sur l'atome d'azote, d'un doublet non partagé qui confère à la molécule des propriétés basiques et une réactivité nucléophile. Les amines primaires et secondaires présentent en outre une réactivité particulière, liée à la présence d'un atome d'hydrogène acide sur le groupe fonctionnel. Ces propriétés sont qualitativement voisines de celles des alcools mais d'intensité différente : les amines sont plus basiques et plus nucléophiles. Les amines primaires, avec deux atomes d'hydrogène sur l'azote, ont quelques réactions spécifiques.
Réactions communes aux trois classes d'amines
Basicité. Les amines des trois classes sont des bases de Lewis : elles forment, avec les acides, des adduits dans une réaction équilibrée. Vis-à-vis du proton et en phase gazeuse, c'est-à-dire en l'absence de solvatation des ions, la réaction :
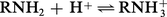
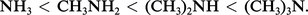
En solution aqueuse, par contre, la réaction :
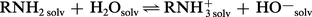
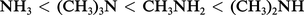
L' intensité de la solvatation des cations ammonium primaire, secondaire et tertiaire décroît dans cet ordre du fait de la diminution du nombre des atomes d'hydrogène, sites de solvatation par l'eau. La concurrence de ces deux effets : inducteur, croissant avec le nombre des groupes alkyle, et de solvatation, décroissant dans le même ordre, confère à l'amine secondaire la basicité la plus forte.
D'autres acides que le proton conduisent à des adduits analogues ; c'est ainsi que, comme l'ammoniac, les amines complexent certains ions métalliques tels que Cu++, Ag+, Co+++, etc. Toutefois, la solubilité dans l'eau de ces produits est souvent différente de celle des dérivés de l'ammoniac. Certains édifices, sensibles à l'action des hydrogènes acides, ne peuvent être complexés que par les amines tertiaires ; c'est le cas des organomagnésiens pour lesquels ces dernières peuvent remplacer l'éther solvatant.
Réactions faisant intervenir l'hydrogène mobile
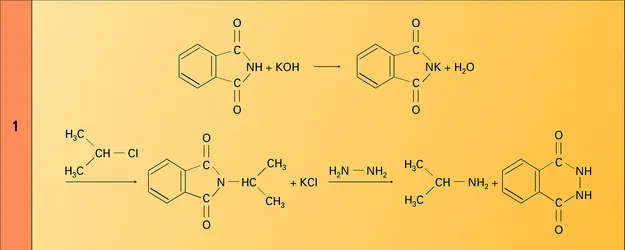
Les amines primaires et secondaires sont des acides très faibles dont le pKa est de l'ordre de 35. Leur transformation en sel métallique nécessite l'intervention de bases plus fortes, comme les organolithiens ou les organomagnésiens. L'emploi de l'amidure de sodium, moins basique, est rendu possible par l'élimination de l'ammoniac formé.
Addition
Les amines primaires et secondaires interviennent dans de nombreuses réactions d'addition nucléophile, l'atome d'azote se fixant sur le site électrophile et l'hydrogène sur le site nucléophile.
Addition sur les aldéhydes et les cétones : les amines primaires forment un hémiaminal qui se déshydrate facilement en donnant une aldimine ou une cétimine. Les amines secondaires forment également un hémiaminal dont la déshydratation conduit à une énamine, l'élimination de l'eau se faisant par entraînement azéotropique (réactions). Lorsque l'aldéhyde est le méthanal et que la réaction est faite en présence d'un substrat énolisable (aldéhyde, cétone, phénol), l'amine secondaire réagit en formant un dérivé d'aminométhylation du substrat ; c'est la réaction de Mannich (1917), généralement catalysée par un acide (réaction).
Addition sur les isocyanates : l'addition des amines primaires et secondaires est facile et conduit aux urées substituées :

Addition sur les nitriles : ces composés, activés par un groupe électro-attracteur, additionnent les amines primaires et secondaires en formant des amidines :

Addition sur le[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Médias
Autres références
-
ALDÉHYDES ET CÉTONES
- Écrit par Jacques METZGER
- 7 350 mots
- 4 médias
...formée, se condense avec deux molécules de méthanal en un composé tétracyclique, ayant une structure analogue à celle de l'adamantane, l'hexaméthylènetétramine (réaction). Les aldéhydes et les cétones réagissent de même avec les amines primaires, en donnant des imines substituées, plus stables. -
AMIDES
- Écrit par Jacques METZGER
- 1 921 mots
- 3 médias
...réalisée au moyen de l'hydrure complexe LiAlH4 (NaBH4 ne réduit pas) : on obtient les amines primaires, secondaires et tertiaires de même squelette (réactions 19). La réduction par le sodium et l'alcool (réaction de Bouveault et Blanc) conduit à un mélange d'alcool et d'amine. -
AMINOACIDES ou ACIDES AMINÉS
- Écrit par Encyclopædia Universalis et Pierre KAMOUN
- 3 486 mots
- 6 médias
Detrès nombreuses réactions utilisent la réactivité de la fonction amine : elles sont particulièrement utilisées pour marquer les groupements NH2 terminaux des peptides ou protéines. C’est également sur des groupements NH2 que l’on peut greffer des marqueurs de nature diverse, fluorescents... -
ANILINE
- Écrit par Alain TRINQUIER
- 1 375 mots
- 2 médias
L' aniline est un composé organique renfermant une fonction amine primaire, c'est-à-dire un atome d'azote lié à un carbone et à deux hydrogènes ; l'atome de carbone appartenant à un noyau benzénique, il s'agit d'une amine aromatique, la plus simple de toutes. Elle a pour formule...
- Afficher les 13 références