AMINOACIDES ou ACIDES AMINÉS
Article modifié le
Propriétés physico-chimiques des acides aminés libres
Propriétés physiques
Les acides aminés se présentent sous forme de solides blancs, cristallisés, solubles dans l'eau où ils donnent des solutions incolores. Les moins solubles sont la cystine, la tyrosine, la leucine.
Ionisation
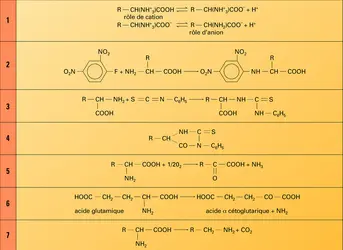
Les aminoacides possèdent au moins deux groupes ionisables : la fonction carboxylique et la fonction amine. Lorsque ces groupes fonctionnels sont simultanément dissociés, les aminoacides sont sous la forme d'ions mixtes R−CH−NH+3, COO– (zwitterions). À bas pH, l'aminoacide est considéré comme un diacide qui perd un premier proton, en se transformant en ion mixte si le pH s'élève. Un deuxième proton est ensuite libéré quand l'ion mixte se transforme en anion.
Le pH auquel la molécule possède une charge nette nulle est appelé « isoélectrique »
; dans ce cas, l'aminoacide ne migre pas dans un champ électrique et sa solubilité est minimale.
Absorption ultraviolette
Les aminoacides n'absorbent pas les rayonnements dans la partie visible du spectre, mais possèdent un pouvoir d'absorption considérable avant 230 nanomètres (nm). De plus, certains aminoacides absorbent entre 250 et 300 nm, grâce à la présence, dans leur radical R, de chromophores spéciaux : indole pour le tryptophane, benzène pour la phénylalanine et la tyrosine.
Stéréo-isomérie
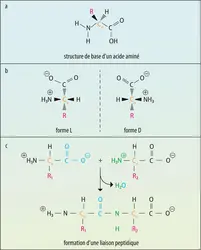
Tous les acides aminés naturels, sauf la glycine, possèdent un carbone asymétrique et sont actifs sur la lumière polarisée. C'est ce carbone qui porte la fonction amine, la fonction carboxylique, un atome d'hydrogène et le radical R. L'alanine se présente ainsi sous deux formes, L ou Dalanine, qui sont deux isomères optiques ou énantiomorphes. La forme D possède une structure spatiale analogue à celle du Dglycéraldéhyde, qui est le corps de référence, tandis que la forme L correspond au Lglycéraldéhyde. La terminologie DL ne correspond pas au pouvoir rotatoire de la substance qui doit être indiqué par un signe + ou − suivant son caractère dextrogyre ou lévogyre : exemple L (+) isoleucine, L (−) leucine.
Lorsque l'acide aminé possède deux carbones asymétriques (thréonine, isoleucine, hydroxylysine, hydroxyproline…), on retrouve quatre isomères : l'isomère naturel porte simplement le préfixe L (ex. : Lisoleucine), l'énantiomorphe sera la Disoleucine ; les deux autres isomères seront la D et la Lallo-isoleucine.
Les aminoacides naturels sont tous de la série L ; toutefois, quelques aminoacides de la série D ont été retrouvés dans les micro-organismes.
Propriétés chimiques
Les propriétés chimiques sont dues à l'existence d'un groupe carboxyle, d'un groupe amine, à la coexistence de ces deux groupes et à la structure du radical R.
Réactions du groupe carboxyle
Deux réactions sont particulièrement importantes : l' estérification et la décarboxylation.
L'estérification des aminoacides permet leur transformation en dérivés volatils au cours de l'analyse par chromatographie en phase gazeuse, les estersn-butyliques étant les plus utilisés.
La décarboxylation des aminoacides conduit à la formation d'amines, dont certaines jouent un rôle biologique essentiel (histamine en allergie, par exemple).
Réactions du groupe amine
De très nombreuses réactions utilisent la réactivité de la fonction amine : elles sont particulièrement utilisées pour marquer les groupements NH2 terminaux des peptides ou protéines. C’est également sur des groupements NH2 que l’on peut greffer des marqueurs de nature diverse, fluorescents par exemple, très utilisés en biologie cellulaire.
La détermination chimique de la séquence des acides aminés dans une protéine utilise une N-arylation ou l'action de l'isothiocyanate de phényle, sur l’acide aminé en position N-terminale.
Le dinitro-2, 4 fluorobenzène[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Pierre KAMOUN : professeur de biochimie à l'université René-Descartes, chef de service à l'hôpital Necker, Paris
- Encyclopædia Universalis : services rédactionnels de l'Encyclopædia Universalis
Classification
Médias
Autres références
-
ADN (acide désoxyribonucléique) ou DNA (deoxyribonucleic acid)
- Écrit par Michel DUGUET , Encyclopædia Universalis , David MONCHAUD et Michel MORANGE
- 10 074 mots
- 10 médias
...mérite de proposer le premier l'idée d'un code génétique, c'est-à-dire une correspondance précise entre la succession des bases dans l'ADN et celle des acides aminés dans les protéines. Les quatre bases constituant l'ADN (adénine, cytosine, guanine et thymine) correspondent à quatre lettres... -
AMINOACIDES INDISPENSABLES
- Écrit par Geneviève DI COSTANZO
- 601 mots
Au début du xxe siècle, les recherches de Wilcock et de Hopkins montrèrent que certaines protéines (gélatine, zéine) sont incapables, malgré un apport azoté quantitativement suffisant, de maintenir l'équilibre nutritif de l'animal et d'assurer sa croissance. L'adjonction à ce régime de certains...
-
ANTIGÈNES
- Écrit par Joseph ALOUF
- 7 384 mots
- 5 médias
Ces antigènes sont essentiellement des polypeptides de synthèse obtenus par polymérisation d'acides aminés sous forme de chaîne polypeptidique. Un premier type de polymères, les poly(α-aminoacides) de composition et de structure beaucoup plus simples que celles des protéines comparées à partir... -
BACTÉRIOLOGIE
- Écrit par Jean-Michel ALONSO , Jacques BEJOT , Michel DESMAZEAUD , Didier LAVERGNE et Daniel MAZIGH
- 18 335 mots
- 11 médias
...certain seuil de concentration. On appelle rétro-inhibition le mécanisme qui inhibe l'activité enzymatique de la première enzyme d'une voie métabolique par le produit final de cette voie. Il en est ainsi dans la production de lysine, acide aminé essentiel pour l'alimentation animale. - Afficher les 67 références
Voir aussi
- POLYPEPTIDES
- ENZYMES
- IONISATION
- PHÉNYLALANINE
- TYROSINE
- CHROMOPHORE
- DOPAMINE
- MAO (monoamine oxydase)
- GLYCOGÈNE
- DÉSAMINATION
- OXYDATION
- ALANINE
- ASPARTIQUE ACIDE
- COENZYMES ou COFACTEURS ENZYMATIQUES
- ISOÉLECTRIQUE POINT
- POLYPEPTIDIQUE CHAÎNE
- TRANSAMINATION
- DOPA (dihydroxyphénylalanine)
- DÉCARBOXYLATION
- GLUTAMIQUE ACIDE
- HISTIDINE
- FLAVINE ADÉNINE DINUCLÉOTIDE (FAD)
- NICOTINAMIDE ADÉNINE DINUCLÉOTIDE PHOSPHATE (NADP)
- TYRAMINE
- DÉCARBOXYLASES
- TRANSAMINASE
- MÉTABOLISME DES GLUCIDES
- ESTÉRIFICATION
- PYRUVIQUE ACIDE
- NICOTINAMIDE ADÉNINE DINUCLÉOTIDE (NAD)
- GLUCONÉOGENÈSE ou NÉOGLUCOGENÈSE
- TRYPTOPHANE
- STÉRÉO-ISOMÉRIE
- ÉNANTIOMÈRES ou INVERSES OPTIQUES ou ANTIPODES OPTIQUES
- DÉSHYDROGÉNASES
- PROTÉINES
- PEPTIDIQUE LIAISON