AMMONIAC
Article modifié le
L'ammoniac est surtout connu par sa synthèse qui, en apportant une solution au problème de la fixation de l'azote de l'air, a révolutionné l'industrie chimique, ouvrant la voie à une technique nouvelle : celle des opérations sous pression. Il constitue maintenant l'un des produits chimiques dont le tonnage de production est très important, car, avec l'ammoniac, la chimie offre à l'homme l'une de ces possibilités étonnantes dont il peut se servir pour le bien ou le mal : constituant et matière première de la plupart des engrais azotés, il sert également à fabriquer l'acide nitrique, lui-même utilisé dans la fabrication de la plupart des explosifs.
Historique
On connaît depuis l'Antiquité le « sel ammoniac », c'est-à-dire le chlorure d'ammonium NH4Cl, dont le nom viendrait de celui du dieu égyptien Amon et qui, initialement obtenu par sublimation, en décomposant par la chaleur la fiente de chameau, était importé d'Orient.
En chauffant ce « sel » avec de la chaux, plusieurs alchimistes constatèrent la formation d'un gaz suffocant, mais ce fut Joseph Priestley qui, en 1774, l'isola en le recueillant sur la cuve à mercure et lui donna le nom « d'air alcalin ». Le nom d' ammoniaque par lequel on désigne aujourd'hui la solution aqueuse du gaz ammoniac, fut proposé par Torbern Olof Bergmann. Priestley avait été amené à considérer ce gaz comme un composé d' azote et d'hydrogène ; cela fut confirmé par Claude Louis Berthollet, qui, en 1785, en fit l'analyse et indiqua sa composition ; celle-ci correspond à la formule NH3, qui fait de ce produit le plus simple des hydrures d'azote.
Jusqu'au milieu du xixe siècle on a extrait l'ammoniac des eaux-vannes, dans lesquelles il se forme par décomposition de l'urée : après 1850, on l'a obtenu comme sous-produit de l'industrie du gaz. La carbonisation de la houille donne lieu en effet à la formation d'ammoniac, qui se condense sous forme d'eaux ammoniacales avec les goudrons.
Les gaz de fours à coke contiennent aussi de l'ammoniac que l'on fixa généralement, lorsqu'on entreprit leur traitement, à l'état de sulfate d'ammonium, utilisé comme engrais ; on s'était en effet rendu compte, entre-temps, de l'importance de l'ammoniac comme constituant des engrais azotés, et c'est cette question des engrais qui devait révolutionner la préparation de l'ammoniac et aussi l'industrie chimique.
C'est dans la seconde moitié du xixe siècle que s'est posé le problème de la fixation de l'azote de l'air. Devant la crainte de la famine mondiale prédite par l'économiste anglais Thomas Robert Malthus, on a entrepris l'exploitation agricole intensive grâce à l'utilisation d'engrais chimiques. On eut recours initialement, comme engrais azotés, aux nitrates du Chili ; mais craignant que leurs gisements ne soient trop rapidement épuisés, on a estimé nécessaire de faire appel à cette source intarissable constituée par l'azote atmosphérique, qu'on a cherché à fixer à l'état de composés susceptibles d'être transformés en engrais.
Les premières réalisations pratiques effectuées dans cette voie ont consisté en synthèses indirectes de l'ammoniac : préparation de cyanures par action, à haute température, de l'azote sur le carbone en présence de bases, puis hydrolyse de ces sels, obtention de cyanamide calcique (CaCN2) qu'on hydrolyse en présence de soude :
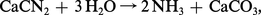
La synthèse directe réalisée industriellement dès 1913 par Fritz Haber devait supplanter tous ces procédés,[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Henri GUÉRIN : ingénieur de l'École supérieure de physique et chimie industrielles, professeur honoraire de l'université de Paris-XI
Classification
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 367 mots
- 7 médias
Lastructure de l'ammoniac liquide, qui bout à — 33 0C, rappelle beaucoup celle de l'eau, en raison de l'existence de liaisons hydrogène. Il s'ionise suivant :Ke = [NH4+][NH2—]est de l'ordre de 3 × 10—33. La limite inférieure de l'échelle d'acidité est par...
-
ALDÉHYDES ET CÉTONES
- Écrit par Jacques METZGER
- 7 356 mots
- 4 médias
L'ammoniac s'additionne sur les aldéhydes, en formant un hémiaminal instable, qui se déshydrate en donnant une aldimine, généralement trimère. Le méthanal réagit d'une manière particulière avec l'ammoniac : la formaldimine, initialement formée, se condense avec deux molécules de méthanal en un composé... -
AMINES
- Écrit par Jacques METZGER
- 3 235 mots
- 4 médias
L' alkylation de l'ammoniac par les halogénures d'alkyle en solution aqueuse ou alcoolique est la méthode proposée en 1850 par A. W. von Hofmann pour leur préparation. Cette réaction conduit à un mélange de dérivés primaires, secondaires et tertiaires, ainsi qu'à l'halogénure d'ammonium quaternaire.... -
ARGENT, métal
- Écrit par Robert COLLONGUES
- 5 167 mots
- 6 médias
- Afficher les 23 références
Voir aussi
- SELS
- NITRATATION
- NEUTRALISATION, chimie
- HYDROLYSE
- HYDROGÈNE LIAISON
- AMPHOTÈRE CORPS
- BASE, chimie
- CONSTANTE DE DISSOCIATION
- EAU, physico-chimie
- CATALYSEURS
- HYDRURES
- CHIMIQUES INDUSTRIES
- AMMONIACATES
- GAZ DE FOURS
- OXYDATION
- RÉACTEUR CHIMIQUE
- URÉE
- RÉDUCTEUR, chimie
- COMPRESSEURS
- SCHWEITZER LIQUEUR DE
- NITROJECTION
- CARBOCHIMIE & PÉTROCHIMIE
- EXOTHERMIQUE RÉACTION
- AMMONIAQUE
- AMIDURES
- AMMINES
- ÉCHANGEUR DE CHALEUR
- GAZEUX ÉTAT
- DÉSULFURATION
- AZOTE ATMOSPHÉRIQUE
- CYANHYDRIQUE ACIDE
- NITRATES
- CHIMIE HISTOIRE DE LA
- MONOXYDE DE CARBONE ou OXYDE DE CARBONE (CO)
- GAZ DE SYNTHÈSE