AMMONIAC
Article modifié le
Propriétés chimiques
Il convient de distinguer les propriétés du gaz ammoniac de celles de ses solutions aqueuses (ammoniaque). Dans la molécule à l'état gazeux, l'azote est au degré d'oxydation minimal (–3), ce qui explique ses propriétés réductrices. La présence d'un doublet libre, qui traduit une non-saturation de la molécule, se manifeste par des réactions d'addition ; enfin certaines réactions de substitution lui confèrent des propriétés acides.
L'ammoniac est relativement peu stable. Il se décompose aisément lorsqu'on le chauffe au contact des métaux :
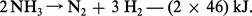
Cette tendance à la décomposition, avec formation d'hydrogène, explique les propriétés réductrices de ce composé qui brûle dans l'oxygène :
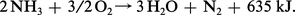
En présence d'une toile de platine portée à 700-800 0C l'azote passe au degré + 2 en formant du monoxyde d'azote (oxyde azotique). C'est la réaction de base de la synthèse de l'acide nitrique :

L' oxydation ménagée opérée en présence de méthane donne lieu à la formation d'acide cyanhydrique ; c'est ainsi qu'on réalise industriellement la synthèse de cet acide :
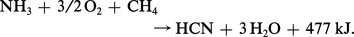
L'ammoniac brûle dans le chlore en donnant de l'acide chlorhydrique et du chlorure d'ammonium ; s'il ne s'enflamme pas immédiatement, il peut se produire du trichlorure d'azote NCl3 qui est explosif.
L'ammoniac se fixe sur de nombreux composés en donnant des ammoniacates comparables aux hydrates, mais en général moins stables, c'est-à-dire plus aisément dissociables : 2AgCl ( 3NH3 et AgCl ( 3NH3 notamment. Il réagit également sur les acides pour former les sels d'ammonium qui sont volatils et généralement dissociables :
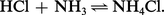
Avec l'anhydride carbonique, sous pression, il fournit le carbamate d'ammonium :
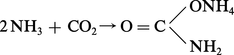
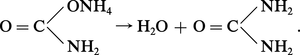
Par action de l'ammoniac sur du sodium ou du potassium porté à 400 0C, il se forme un amidure alcalin, blanc, cristallisé, selon la réaction :
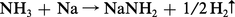
La formation d'amines R — NH2, par action de l'ammoniac sur les alcools ou sur les halogénures d'alcoyles, et celle d'amides par action sur les chlorures d'acides constituent également des réactions de substitution.
On a indiqué précédemment que l'ammoniac en solution aqueuse ou ammoniaque constituait une base faible. Les sels d'ammonium souvent isomorphes de ceux de potassium sont hydrolysables, volatils et dissociables. C'est à ce titre de base que l'ammoniaque précipite les hydroxydes insolubles de leurs solutions salines :
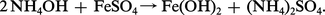
En présence de nombreux sels, l'ammoniaque fournit des ammoniacates et, notamment avec ceux de cobalt, de nickel, de cuivre, d'argent, etc., des complexes qu'on appelle des ammines : par exemple le chlorure d'hexammine cobalt III :

Les solutions d'ammoniac sont oxydables ; ainsi, avec le chlore, le brome ou l'hypobromite il se forme de l'azote :
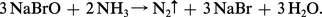
En présence d'hypochlorite on obtient d'abord la chloramine :
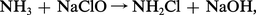
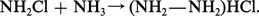
En présence de cuivre, l'ammoniaque fixe l'oxygène de l'air en donnant une solution bleu céleste dite liqueur de Schweizer qui contient de l'hydroxyde de cuivre II tétrammine [Cu(NH3)4](OH)2, base forte qui dissout la cellulose.
Ce caractère oxydable de l'ammoniac explique les transformations que subit ce composé dans le sol, sous l'action de certaines bactéries : les sels ammoniacaux donnent d'abord des nitrites, puis des nitrates, c'est le phénomène de la nitratation démontré par J. J. Schlœsing et son élève A. Muentz et par S. Winogradski.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Henri GUÉRIN : ingénieur de l'École supérieure de physique et chimie industrielles, professeur honoraire de l'université de Paris-XI
Classification
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 367 mots
- 7 médias
Lastructure de l'ammoniac liquide, qui bout à — 33 0C, rappelle beaucoup celle de l'eau, en raison de l'existence de liaisons hydrogène. Il s'ionise suivant :Ke = [NH4+][NH2—]est de l'ordre de 3 × 10—33. La limite inférieure de l'échelle d'acidité est par...
-
ALDÉHYDES ET CÉTONES
- Écrit par Jacques METZGER
- 7 356 mots
- 4 médias
L'ammoniac s'additionne sur les aldéhydes, en formant un hémiaminal instable, qui se déshydrate en donnant une aldimine, généralement trimère. Le méthanal réagit d'une manière particulière avec l'ammoniac : la formaldimine, initialement formée, se condense avec deux molécules de méthanal en un composé... -
AMINES
- Écrit par Jacques METZGER
- 3 235 mots
- 4 médias
L' alkylation de l'ammoniac par les halogénures d'alkyle en solution aqueuse ou alcoolique est la méthode proposée en 1850 par A. W. von Hofmann pour leur préparation. Cette réaction conduit à un mélange de dérivés primaires, secondaires et tertiaires, ainsi qu'à l'halogénure d'ammonium quaternaire.... -
ARGENT, métal
- Écrit par Robert COLLONGUES
- 5 167 mots
- 6 médias
- Afficher les 23 références
Voir aussi
- SELS
- NITRATATION
- NEUTRALISATION, chimie
- HYDROLYSE
- HYDROGÈNE LIAISON
- AMPHOTÈRE CORPS
- BASE, chimie
- CONSTANTE DE DISSOCIATION
- EAU, physico-chimie
- CATALYSEURS
- HYDRURES
- CHIMIQUES INDUSTRIES
- AMMONIACATES
- GAZ DE FOURS
- OXYDATION
- RÉACTEUR CHIMIQUE
- URÉE
- RÉDUCTEUR, chimie
- COMPRESSEURS
- SCHWEITZER LIQUEUR DE
- NITROJECTION
- CARBOCHIMIE & PÉTROCHIMIE
- EXOTHERMIQUE RÉACTION
- AMMONIAQUE
- AMIDURES
- AMMINES
- ÉCHANGEUR DE CHALEUR
- GAZEUX ÉTAT
- DÉSULFURATION
- AZOTE ATMOSPHÉRIQUE
- CYANHYDRIQUE ACIDE
- NITRATES
- CHIMIE HISTOIRE DE LA
- MONOXYDE DE CARBONE ou OXYDE DE CARBONE (CO)
- GAZ DE SYNTHÈSE