ANTIBIORÉSISTANCE
Article modifié le
Mondialisation des antibiorésistances
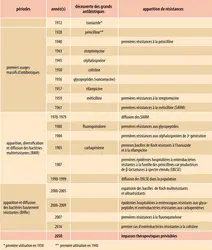
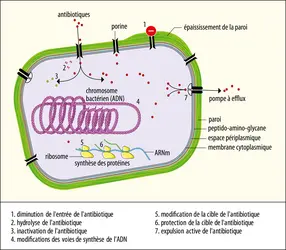
L’antibiorésistance n’est pas un phénomène nouveau. En effet, dès la mise sur le marché des premiers antibiotiques dans les années 1940-1950 (pénicillines, sulfamides, aminosides…), il a rapidement été mis en évidence des mécanismes de résistance chez plusieurs espèces bactériennes d’importance clinique (Staphylococcus aureus, Escherichia coli…). Chaque nouvelle génération d’antibiotiques a vu apparaître de nouveaux mécanismes de résistance jusque-là ignorés, dont la diffusion s’exerce de multiples façons à partir de bactéries « réservoirs » de gènes de résistance. En effet, de nombreuses bactéries retrouvées dans l’eau ou dans le sol portent des gènes de résistance chromosomique ou plasmidique, qui peuvent occasionnellement se transmettre à des espèces potentiellement pathogènes pour l’humain. Initialement sensible aux pénicillines, Staphylococcus aureus ne l’est quasiment plus depuis bien longtemps – plus de 90 % des souches mondiales y sont résistantes aujourd’hui. Cela témoigne de la constante pression de sélection en antibiotiques dans l’environnement à travers l’espace et le temps, mais aussi de l’avantage sélectif conféré par ces gènes pour, par exemple, résister à l’action des antibiotiques naturellement produits par d’autres micro-organismes.
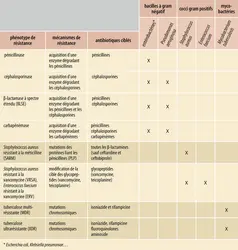
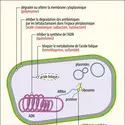
L’augmentation importante du nombre de bactéries résistantes à plusieurs antibiotiques, dites multirésistantes (BMR), identifiées dès les années 1970, a compliqué la lutte car elle a réduit le nombre de molécules efficaces. Les premières β-lactamases à spectre étendu (BLSE), enzymes qui dégradent les pénicillines et certaines céphalosporines, ont alors commencé à diffuser chez les entérobactérales (Escherichia coli, Klebsiella pneumoniae, Citrobacterfreundii…). Les premières BLSE sont apparues par mutation ponctuelle d’enzymes de type pénicillinases (β-lactamases) permettant un élargissement de leur spectre d’action aux céphalosporines. Le passage de ces gènes de résistance sur des plasmides hautement transmissibles a occasionné les premières épidémies, essentiellement à l’hôpital. À la fin des années 1990, de nouvelles BLSE dénommées CTX-M – pour « céfotaximase-Munich » car identifiées pour la première fois en Allemagne – ont radicalement changé l’épidémiologie et la répartition des profils de résistance à l’échelle mondiale. D’après le rapport de 2020 de surveillance de la consommation d’antibiotiques en établissement de santé (Santé publique France), près de 10 % des entérobactérales isolées en clinique sont porteuses de BLSE en France. Ce chiffre peut monter à plus de 50 % dans certains pays, où l’utilisation massive d’antibiotiques dans la population générale, le manque de réglementations sanitaires ou encore le commerce non contrôlé d’antibiotiques concourent à la sélection de ces clones résistants. L’origine des CTX-M a pu être identifiée chez certaines entérobactéries environnementales aquatiques (Kluyveraascorbata) où des gènes chromosomiques présentent une haute homologie de structure avec ceux des bactéries résistantes en clinique. Ceux-ci ont très probablement été mobilisés par des transposons à partir de l’environnement naturel puis ont diffusé via un vecteur plasmidique. L’environnement constitue donc un réservoir probablement important de gènes de résistance.
Parmi les bactéries multirésistantes, le Staphylococcus aureus résistant à la méticilline (ou SARM) occupe également une place importante. Après la découverte de premiers isolats résistants à la pénicilline deux ans après la commercialisation de la pénicilline G en 1944, le développement de nouvelles pénicillines insensibles à l’action des pénicillinases a conduit à la mise sur le marché en 1960 de la méticilline. Son excellente efficacité fut rapidement[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Aurélie CHABAUD : pharmacienne-biologiste spécialisée, laboratoire de bactériologie virologie hygiène, CHU de Limoges
- Sylvain MEYER : assistant hospitalo-universitaire, laboratoire de bactériologie virologie hygiène, CHU de Limoges
- Marie-Cécile PLOY : professeure des Universités, praticienne hospitalière, laboratoire de bactériologie virologie hygiène, CHU de Limoges
Classification
Médias
Autres références
-
ALIMENTATION (Aliments) - Risques alimentaires
- Écrit par Jean-Pierre RUASSE
- 4 759 mots
- 1 média
...thérapeutique anti-infectieuse d'une part, accélération de la croissance d'autre part. Mais cette utilisation entraîne trois ordres de conséquences néfastes : augmentation de la résistance des germes pathogènes, transformation en pathogènes de variétés jusque-là saprophytes, enfin création chez le consommateur... -
ANTIBIOTIQUES
- Écrit par Aurélie CHABAUD , Sylvain MEYER et Marie-Cécile PLOY
- 6 760 mots
- 6 médias
Larésistance aux antibiotiques constitue une menace mondiale, accentuée par le mésusage de ces médicaments. Une utilisation raisonnée et raisonnable des antibiotiques est nécessaire pour limiter son apparition et sa diffusion. Pour cela, la prescription d’antibiotiques s’appuiera sur la règle de « médecine... -
ANTIBIOTIQUES - (repères chronologiques)
- Écrit par Paul MAZLIAK
- 461 mots
1903 Découverte du Trypan Röd (premier antibiotique anti-parasitaire) par Paul Ehrlich (1854-1915).
1909 Découverte du Salvarsan (606), puissant anti-syphilitique par Paul Ehrlich.
1921 Synthèse du Stovarsol (anti-microbien peu toxique dérivé de l'arsenic) par Ernest Fourneau (1872-1949)....
-
BACTÉRIES
- Écrit par Jean-Michel ALONSO , Jacques BEJOT et Patrick FORTERRE
- 11 055 mots
- 3 médias
...gluante très riche en eau, les biofilms forment des biomasses épaisses au sein desquelles les micro-organismes acquièrent des propriétés particulières telles qu'une résistance très élevée aux antibiotiques. Les biofilms formés par des bactéries pathogènes sont particulièrement difficiles à éliminer et représentent... - Afficher les 17 références
Voir aussi
- VIRULENCE, microbiologie
- ENZYMES
- MICRO-ORGANISME
- GÉNOTYPE
- INFECTION
- SÉQUENÇAGE, génétique moléculaire
- RÉSISTANCE, biologie
- EAUX USÉES
- ENTÉROBACTÉRIES
- RIFAMPICINE
- RISQUES SANITAIRES
- SANTÉ DANS LE MONDE
- CHROMOSOMES
- RÉSISTANCE BACTÉRIENNE
- PÉNICILLINE
- ÉPIDÉMIES
- CONJUGAISON BACTÉRIENNE
- ISONIAZIDE
- TRANSPOSON
- SIRTURO ou BEDAQUILINE
- ÉLEVAGE INDUSTRIEL
- MICROBIOTES
- COLISTINE