ANTIMOINE
Composés de l'antimoine
Composés oxygénés
L' oxyde d'antimoine III peut être produit soit par oxydation directe du métal fondu, soit par hydrolyse de sels, en particulier du chlorure en milieu faiblement basique. Deux variétés cristallines, stables à haute et basse températures, sont connues à l'état naturel, car le passage à la variété stable, à la température ambiante, est extrêmement lent.
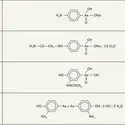
La variété cubique cristallise sous forme d'octaèdres : comme dans le cas de l'oxyde d'arsenic, le réseau est analogue à celui du diamant, dans lequel les groupes Sb4O6 occupent les positions habituelles des atomes de carbone. La forme stable à haute température possède une structure en chaînes formées alternativement d'un atome d'antimoine et d'un atome d'oxygène. Ces chaînes sont pontées entre elles par des atomes d'oxygène situés entre deux atomes d'antimoine. Par chauffage, cet oxyde peu stable évolue rapidement et réagit avec les composés ou éléments placés à son contact. Dans l'air, il se transforme en oxyde mixte Sb2O4 ; dans un courant d'hydrogène ou en présence de carbone, il est facile à réduire et, mélangé à du soufre, il passe à l'état de trisulfure. Comme l'oxyde d'arsenic homologue, cet oxyde d'antimoine est indifférent, avec accentuation nette du caractère basique. Il est très peu soluble dans l'eau et les acides dilués ; avec les acides concentrés, il donne des sels d'antimoine III, comme le sulfate Sb2(SO4)3 ou le nitrate Sb(NO3)3 ; il est également soluble dans plusieurs acides organiques, dont l'acide tartrique. Par action des bases, il se forme des méta-antimonites, comme NaSbO2, 3H2O dans le cas de la soude. Par hydrolyse, à basse température, des gels d'oxyde hydraté ont été préparés ; ils perdent leur eau très facilement. Aucun hydrate défini n'a pu être isolé. Le trioxyde chauffé dans l'air absorbe de l'oxygène dès 300 0C pour donner l'oxyde Sb2O4 qui se décompose au-delà de 900 0C en redonnant le trioxyde. Ce composé doit être considéré comme un antimoniate antimonieux : SbIII(SbVO4) ; cette structure est attestée par l'action d'une solution de potasse qui conduit à un mélange d'antimoine et d'antimoniate de potassium ; par ailleurs, la structure est identique à celle du tantalate d'antimoine SbIII(TaVO4). L'oxyde d'antimoine V se forme par action de l'acide nitrique concentré sur une solution antimonieuse. L'oxyde hydraté obtenu peut être difficilement déshydraté sans perte d'oxygène. Aucun acide antimonique n'a pu être isolé des solutions qui contiennent un monoacide hexahydroxylé de formule H(Sb(OH)6) et dont la constante de dissociation vaut 5 . 105. Les sels correspondants de sodium et de potassium sont bien connus. Les antimoniates anhydres peuvent être préparés par voie sèche, par fusion d'oxydes en proportion stœchiométrique ; ils ont une structure complexe et, en particulier, les diantimoniates de métaux divalents, comme Ca2Sb2O7, semblent suggérer l'existence d'un acide pyroantimonique, à rapprocher de l'acide pyrophosphorique, alors qu'en réalité aucun groupe Sb2O72- n'existe dans le cristal ; celui-ci possède un réseau continu comme celui de certains silicates ou aluminosilicates.
Autres sels d'antimoine
Les sulfures, correspondant aux deux degrés d'oxydation, sont faciles à préparer par action directe du soufre, en proportions calculées, sur l'antimoine métallique, ou par voie aqueuse, en faisant agir un courant d'hydrogène sulfuré sur une solution acide d'antimoine tri- ou pentaoxydé. Ces sulfures sont proches des sulfures d'arsenic : en milieu très acide ou basique, ils se dissolvent en conduisant aux sels d'antimoine, aux antimonites ou aux antimoniates ; en présence[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean PERROTEY : docteur ès sciences, maître assistant à l'université de Haute-Normandie
- Encyclopædia Universalis : services rédactionnels de l'Encyclopædia Universalis
Classification
Médias
Autres références
-
ARSENIC
- Écrit par Jean PERROTEY
- 4 499 mots
- 2 médias
-
CHINE - Les régions chinoises
- Écrit par Pierre TROLLIET
- 11 778 mots
- 3 médias
-
PHARMACOLOGIE
- Écrit par Edith ALBENGRES , Jérôme BARRE , Pierre BECHTEL , Jean-Cyr GAIGNAULT , Georges HOUIN , Henri SCHMITT et Jean-Paul TILLEMENT
- 20 332 mots
- 9 médias
...engraisser les porcs. Il eut l'idée de le prescrire aux moines amaigris par les jeûnes prolongés. Comme tous les moines moururent, le stibium fut appelé « antimoine » et banni de la thérapeutique. Ce n'est qu'au xviie siècle, à la suite de la guérison grâce à l'antimoine de Louis... -
PLOMB
- Écrit par Claude FOUASSIER , Michel PÉREYRE , Michel RABINOVITCH et Jean-Louis VIGNES
- 6 739 mots
- 3 médias
On peut remédier au manque de dureté du plomb en ajoutant de l' antimoine en proportion de 10 à 20 p. 100, par exemple, dans les caractères d'imprimerie, de 2 p. 100 dans les plaques positives des accumulateurs, de 5 à 8 p. 100 dans les moulages de balles de fusil.