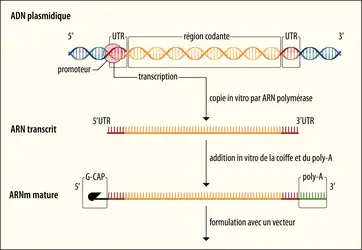
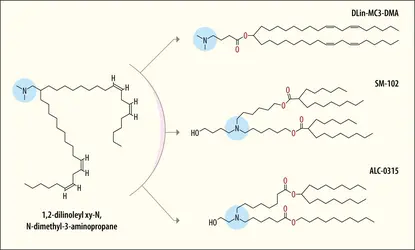
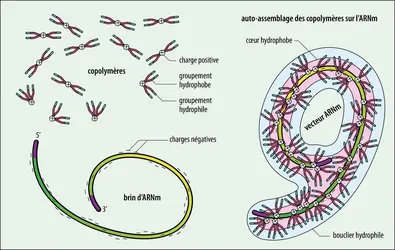
ARNm THÉRAPEUTIQUES
Modalités d’administration des ARNm thérapeutiques
Les différentes voies d’administration des ARNm vectorisés influencent leur distribution dans les organes, leur cinétique d’expression et leur effet thérapeutique. La voie d’administration est déterminée tant par les propriétés physico-chimiques des assemblages vecteurs synthétiques-ARNm que par l’application thérapeutique recherchée. Après injection par voie intraveineuse, la plupart des LNP s’accumulent dans le foie, où les particules sont internalisées dans les hépatocytes par endocytose. Cela est dû au fait que l’apolipoprotéine E (ApoE) possède une affinité pour les lipides vecteurs de l’ARNm et que son récepteur est localisé sur les cellules hépatiques. La biodistribution préférentielle des LNP dans le foie se fait donc par ciblage actif. Comme le foie sécrète naturellement de nombreuses protéines, comme la plupart de celles du sang, il peut être utilisé comme « usine » pour produire des protéines thérapeutiques manquantes dans le cadre de maladies métaboliques – par exemple, la tyrosinémie héréditaire de type I, la porphyrie aiguë intermittente, la maladie de Fabry ou encore le syndrome de Crigler-Najjar – et hématologiques – par exemple, les hémophilies A, et B – ou encore des anticorps pour neutraliser des pathogènes ou cibler des cellules cancéreuses. Cependant, ces nombreuses applications thérapeutiques potentielles ne prendront de l’ampleur que si la réponse immunitaire innée liée à la reconnaissance des molécules d’ARN est suffisamment atténuée. Cette réponse pourrait limiter par exemple la possibilité de répéter les administrations des LNP dans le temps, alors que cela peut s’avérer nécessaire dans le cadre d’une pathologie de déficit où la protéine thérapeutique doit être produite sur le long cours (risque de pathologie auto-immune liée à l’inflammation). Par ailleurs, les LNP injectés dans la circulation générale, peuvent s’accumuler en de multiples ganglions lymphatiques dans l’ensemble du corps, ce qui peut induire une réponse immunitaire contre la protéine exprimée à partir de l’ARNm – bénéfique dans la vaccination à ARNm, mais défavorable pour la thérapie à ARNm.
L’administration topique d’ARNm a pour objectif d’obtenir un effet thérapeutique local, par injection dans des organes précis comme le cœur. Dans ce contexte, des essais cliniques de phase 2 sont conduits en utilisant des molécules d’ARNm sans vecteur. Il s’agit dans ce cas d’induire l’expression d’un facteur de croissance de l’endothélium vasculaire dans le cœur d’individus ayant subi un infarctus du myocarde, pour créer de nouveaux vaisseaux sanguins contournant les zones endommagées non vascularisées. Une approche thérapeutique voisine, avec cette fois-ci des molécules d’ADN, consiste à faire exprimer un facteur de vascularisation au niveau des membres inférieurs dans le cadre d’une oblitération de la circulation sanguine (ischémie périphérique) : elle a débouché sur le premier médicament par expression d’une protéine thérapeutique, le Collategene®.
Dans tous les cas connus, les limites de l’usage in vivo des vecteurs à base de particules lipidiques pour la thérapie à ARNm sont que l’on ne parvient pas encore à contrôler correctement la réponse inflammatoire et la réponse immunitaire. C’est dans ce contexte qu’a été défini le concept d’utilisation de blocs de polymères amphiphiles, et non de lipides, pour la vectorisation intracellulaire de molécules d’ARNm destinée à l’expression de protéines thérapeutiques sans stimuler la réponse immunitaire. La clé pour y parvenir peut être d’internaliser directement les molécules d’ARN dans le cytosol et non par un mécanisme d’endocytose.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Bruno PITARD : directeur de recherche CNRS, unité immunology and new concepts in immunotherapy, Nantes université
Classification
Médias