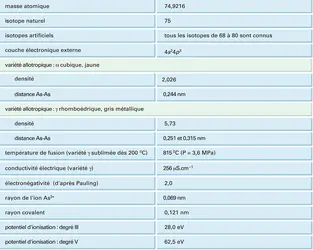
ARSENIC
Article modifié le
Composés
Composés oxygénés
La combustion de l'arsenic, le grillage des pyrites arsenicales dans un courant d'air donnent d'abondantes fumées blanches qui étaient déjà connues au Moyen Âge. Ces fumées sont constituées d'oxyde d'arsenic trivalent et, par condensation à la température ambiante, on recueille une masse vitreuse opaque de densité 3,7 communément appelée « arsenic blanc » ou même simplement « arsenic ». Ce produit cristallise spontanément avec le temps dans le système cubique ; la densité s'élève alors à 3,87. Cette variété cristalline peut être recueillie sous forme d'octaèdres à partir d'une solution chlorhydrique d'anhydride arsénieux ; elle existe dans la nature sous forme d'arsénolite (fleur d'arsenic) ; chaque groupe As4O6 occupe dans le cristal les positions des atomes de carbone dans une structure de type diamant. Cette variété est toujours métastable aux températures supérieures à − 13 0C. Elle se transforme réversiblement en variété monoclinique, stable aux températures plus élevées. La structure stable à chaud possède un système cristallin moins symétrique ; elle est feuilletée, identique à celle de la claudétite naturelle, et sa densité est de 4,15. En phase vapeur, la formule est As4O6 jusque vers 800 0C ; au-delà, la dissociation commence et, à 1 800 0C, il n'existe plus que des molécules As2O3. En solution, des mesures d'ébulliométrie confirment la formule As4O6, et, par diffraction électronique, on a pu montrer que chaque groupe a une structure voisine de celle de As4, chaque liaison As − As étant simplement transformée en liaison As − O − As. Cet oxyde est peu soluble dans l'eau. L'acide arsénieux n'a pas pu être isolé et son existence en solution reste hypothétique. L'existence de nombreux métaarsénites MAsO2 laisse penser qu'il s'agit de l'acide correspondant HAsO2 ou AsO(OH), mais en présence d'ions Ag+ une solution arsénieuse laisse précipiter l'orthoarsénite triargentique Ag3AsO3 : il pourrait donc s'agir de l'acide As(OH)3 ou H3AsO3. Enfin, des mesures physiques effectuées sur les solutions tendent à prouver l'existence d'ions [As (OH)6]3- : l'exposé des propriétés de cet acide est indépendant de sa structure réelle qu'on peut supposer être, pour simplifier, H3AsO3. L'acide arsénieux est très faible et la première constante d'ionisation a été évaluée à 5 . 10-10. En réalité, les solutions arsénieuses sont amphotères :
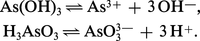
La combinaison de ces deux formes de dissociation permet d'écrire une relation entre les différentes formes ioniques :
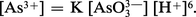
L'influence du pH est donc considérable sur cet équilibre et les sels d'arsenic ne peuvent exister qu'en milieu très acide. Les solutions d'anhydride arsénieux traitées par l'acide sulfurique laissent déposer le sulfate d'arsényle (AsO)2SO4, qui représente un degré d'hydrolyse intermédiaire entre les deux cas extrêmes exposés ci-dessus. Le sulfate d'arsenic As2(SO4)3 peut être préparé par action de l'anhydride sulfurique à 100 0C. L'acétate As(CH3COO)3 est connu ; à l'air humide, il s'hydrolyse totalement en acide acétique et oxyde d'arsenic.
Les arsénites alcalins sont très solubles, ceux des métaux alcalino-terreux le sont moins, ceux des métaux lourds ne le sont pas. Les arsénites à l'état dissous présentent la propriété d'être adsorbés par les gels d'hydroxydes métalliques, ce qui justifie l'ingestion d'hydroxyde de fer comme antidote en cas d'intoxication.
Les solutions arsénieuses sont à la fois faciles à réduire et à oxyder ; les sels stanneux précipitent l'arsenic élémentaire, et un sel ferrique ou une solution d'iode suffit pour faire passer l'arsenic à l'état pentavalent. Les solutions d'anhydride arsénieux traitées par l'ozone ou l'eau oxygénée laissent déposer après évaporation des cristaux d'acide arsénique (H3AsO4, 1/2H2O). L'anhydride arsénique, contrairement à l'anhydride phosphorique, est difficile à obtenir autrement qu'en déshydratant l'acide, à température inférieure à 200 0C pour éviter les pertes d'oxygène.
L'acide arsénique est un triacide dont les constantes de dissociation sont respectivement k1 = 5,6 . 10-3 ; k2 = 1,7 . 10-7 ; k3 = 3,0 . 10-12. Les arséniates sont proches des phosphates par des solubilités semblables et de nombreuses relations d'isomorphie. En présence d'un mélange de chlorures de magnésium et d'ammonium, les solutions d'arsenic (+ V) laissent déposer l'arséniate ammoniaco-magnésien, semblable au phosphate homologue MgNH4AsO4, 7H2O, qui, après calcination, se transforme en pyroarséniate Mg2As2O7 utilisé en gravimétrie.
Il existe un oxyde mixte As2O4 qui doit être regardé comme un arséniate arsénieux et qu'il faudrait écrire AsIII (AsVO4).
Sulfures
Les sulfures As4S3, As4S4, As4S6 et As4S10 peuvent être préparés par voie sèche à partir des éléments en proportions convenables. Par action de l'hydrogène sulfuré sur des solutions contenant de l'arsenic tri- ou pentaoxydé, on obtient facilement As4O6, beaucoup plus difficilement As4O10, car les solutions d'arséniates sont rapidement réduites en arsénite par l'hydrogène sulfuré. Le sulfure trivalent se dissout dans les solutions de polysulfure d'ammonium en se transformant en thioarsénite et dans les bases en donnant un mélange d'arsénite et de thioarsénite :
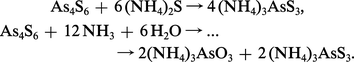
Composés halogénés
Les quatre trihalogénures sont connus ; on peut les préparer par halogénation directe. L'hydrolyse est rapide et totale pour le fluorure et le chlorure, moins rapide pour le bromure et lente dans le cas de l'iodure. Il faut remarquer qu'au cours de l'hydrolyse les oxyhalogénures, stables dans le cas du phosphore, n'apparaissent pas ; aucun n'a pu être préparé. Un seul pentahalogénure, le fluorure, a été caractérisé avec certitude.
Hydrures et dérivés organiques
L' action du zinc en milieu sulfurique dilué transforme un composé quelconque de l'arsenic en hydrogène arsénié ou arsine de formule As H3 ; cette propriété est utilisée en chimie analytique. Ce gaz (température de fusion − 116,3 0C, température d'ébullition − 62,4 0C) peut aussi être obtenu par hydrolyse des arséniures de sodium ou d'aluminium, faciles à préparer par fusion des deux constituants en proportion convenable. Par synthèse directe, on n'a pas pu jusqu'à présent préparer l'arsine, dont la chaleur de formation à partir de l'arsenic et de l'hydrogène est positive, comme celle de l'hydrure d'antimoine. L'ammoniac et les phosphures sont au contraire des composés à formation exothermique. L'arsine est décomposée par la chaleur dès 250 0C, c'est un agent réducteur qui précipite l'argent métallique des solutions de nitrate, brûle dans l'air et peut être oxydé au degré V par les solutions d'iode. L'arsine ne possède pas comme l'ammoniac de fonction basique, et les sels d'arsinium non substitués sont inconnus. Ce composé est fortement toxique ; très pur, il est presque inodore, mais, en général, il possède une odeur alliacée puissante, ce qui facilite sa détection.
Par substitution de radicaux aliphatiques ou aromatiques aux atomes d'hydrogène de l'arsine, puis, par halogénation ou oxydation, plusieurs milliers de composés arsenicaux organiques ont été préparés. Ils représentent la plus importante famille de composés organométalliques. Cela est dû à l'intérêt médical de ces produits et à l'importance de la recherche pharmacologique à travers le monde. Historiquement, c'est en 1760 que Cadet de Gassicourt, distillant un mélange d'anhydride arsénieux et d'acétate de potassium sec, recueillit l'« huile fumante de Cadet », essentiellement constituée d'oxyde de cacodyle :

Dans le cas de simple liaison entre deux atomes d'arsenic, les composés sont semblables aux hydrazines substituées et aux azoïques lorsqu'il s'agit de double liaison ; cette dernière famille, celle des arsénoïques, a connu un développement considérable qui est dû à l'intérêt thérapeutique que présentent les dérivés de l'arsénobenzène C6H5−As=As−C6H5.
Les arsines aliphatiques primaires sont très facilement oxydables et s'enflamment spontanément à l'air ; cette propriété s'atténue chez les arsines plus substituées. Contrairement à l'hydrogène arsénié, des arsines ont une fonction basique faible en solution. La monométhylarsine, liquéfiée à + 2 0C, peut être oxydée par l'oxygène sec en CH3As=O, hydrolysable en acide méthylarsonique. L'iode transforme la monométhylarsine en diiodure CH3AsI2, composé stable, qui résiste plusieurs heures à une température de 300 0C. Les arsines aromatiques ont une stabilité thermique exceptionnelle (la triphénylarsine distille à 360 0C sans décomposition), mais elles s'oxydent très facilement et il faut les conserver dans une atmosphère d'azote.
Les sels d'arsinium quaternaires sont obtenus par une méthode dérivée de celle de Hoffman pour les amines, en traitant la triarsine par l'iodure d'alcoyle correspondant. L'halogène peut être éliminé par action de l'oxyde d'argent humide ; il reste alors une base, blanche, déliquescente, se carbonatant très rapidement et aux propriétés voisines de celles des bases alcalines ; certains de leur sels sont très insolubles, en particulier [(C6H5)4As] (ReO4), qui sert de façon usuelle au dosage gravimétrique du rhénium.
Les acides arsoniques sont des diacides assez forts ; leurs constantes d'acidité sont de l'ordre de 10-4 et 10-9. Les liaisons entre un noyau aromatique et l'atome d'arsenic sont solides et l'acide phénylarsonique peut être traité par les acides nitrique ou sulfurique concentrés et chauds sans que cette liaison soit affectée. Les acides arsiniques sont très faibles et leurs constantes de dissociation ne dépassent pas 10-7 et 10-13 ; ce sont les composés les moins toxiques de l'arsenic. Parmi les diarsines, le cacodyle est particulièrement célèbre ; il fut préparé par Bunsen dès 1842 ; il s'enflamme spontanément à l'air, mais est thermiquement stable jusque vers 400 0C. Un composé curieux, qui a reçu le nom d' arsénométhane, a été isolé en réduisant le méthylarsonate de sodium par l'acide hypophosphoreux ; il s'agit d'un produit huileux jaunâtre cristallisant au-dessous de 12 0C ; sa formule brute peut s'écrire (CH3As)n. Les mesures de cryoscopie ou d'ébullioscopie donnent à n la valeur 5 ; la densité de vapeur correspond à n = 5 vers 200 0C et à n = 3 vers 270 0C. Sa structure est inconnue.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean PERROTEY : docteur ès sciences, maître assistant à l'université de Haute-Normandie
Classification
Médias
Autres références
-
ARSENIC, toxicologie
- Écrit par Encyclopædia Universalis
- 255 mots
L'arsenic entrait autrefois dans la composition de nombreux produits insecticides, raticides, pesticides comme de certaines peintures, papiers peints et céramiques.
L'empoisonnement arsenical chez l'homme résulte souvent de l'ingestion ou de l'inhalation d'un insecticide contenant oxyde arsénieux,...
-
ANTIMOINE
- Écrit par Encyclopædia Universalis et Jean PERROTEY
- 3 876 mots
- 3 médias
...essentiellement par des dérivés organiques, tandis que les composés + III sont les plus nombreux et que la stabilité du degré + V est plus faible que chez l'arsenic. Par l'ensemble de ses propriétés, l'antimoine est très proche de l'arsenic, avec un caractère métallique plus accentué. Le potentiel électrochimique de... -
LÖLLINGITE
- Écrit par Yannick LOZAC'H
- 306 mots
-
MATIÈRE (physique) - État solide
- Écrit par Daniel CALÉCKI
- 8 631 mots
- 12 médias
L'atome d'arsenic possède cinq électrons de valence et trois places vacantes sur sa couche externe. Dans un cristal d'arsenic, chaque atome établit trois liaisons covalentes avec trois atomes premiers voisins. Ces liaisons forment un trièdre, l'angle entre deux liaisons étant égal à 92,8... -
OLIGOÉLÉMENTS
- Écrit par Jean LAVOLLAY
- 3 577 mots
- 1 média
- Afficher les 9 références
Voir aussi