ARSENIC
Intérêt biologique de l'arsenic et de ses composés
Le trioxyde est extrêmement toxique, la dose létale étant de l'ordre de 0,1 gramme. De très nombreux autres composés arsenicaux, triou pentavalents, peuvent être absorbés par l'organisme soit au niveau de la peau, soit par la paroi intestinale. L'excrétion est toujours lente et se fait presque uniquement par la voie urinaire. En cas d'absorption prolongée de produits arsenicaux, par intoxication progressive, il y a fixation par les ongles et les cheveux qui sont, pour cette raison, systématiquement analysés en toxicologie.
Plusieurs composés arsenicaux sont utilisés en thérapeutique ; leur toxicité, même à faible dose, n'étant pas négligeable, on prévoit généralement des périodes de traitement entrecoupées de périodes de repos.
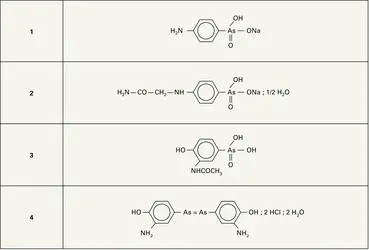
La liqueur de Fowler, constituée par une solution d'arsénite de potassium, titre environ 1 p. 100 en anhydride arsénieux ; on l'utilise comme stimulant de la nutrition. L'anhydride arsénieux améliore le souffle en altitude et les chasseurs de chamois tyroliens ont la réputation d'en consommer régulièrement. Plusieurs dérivés arsenicaux aromatiques sont des antiparasitaires importants, actifs vis-à-vis des tripanosomes et des spirilles. Ces composés jouent un rôle dans la prophylaxie et le traitement de la maladie du sommeil. De nombreux composés voisins sont proposés, parmi lesquels le paraaminophénylarsinate monosodique ou Tripoxyl (formule 1) et le N-phénylglycinamide-p-arsinate de sodium (formule 2). L'acétarsone (formule 3) a été employé dans le traitement de l'amibiase et dans celui de la syphilis. Associé à la quinine, l'acétarsone a été préconisé dans le traitement du paludisme.
Les arsénoïques sont les premiers composés auxquels on a reconnu une action antisyphilitique et, par la suite, on en a utilisé de très nombreux. Historiquement, le premier dont on découvrit les vertus fut l'arsénobenzol (Salvarsan, formule 4). On utilisa ensuite le novarsénobenzol, dans lequel l'un des groupes NH2 est remplacé par −NH−CH2Na. Ces composés sont également de bons antiparasitaires ; leur importance est bien moindre depuis la découverte des antibiotiques.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean PERROTEY : docteur ès sciences, maître assistant à l'université de Haute-Normandie
Classification
Médias
Autres références
-
ARSENIC, toxicologie
- Écrit par Encyclopædia Universalis
- 255 mots
L'arsenic entrait autrefois dans la composition de nombreux produits insecticides, raticides, pesticides comme de certaines peintures, papiers peints et céramiques.
L'empoisonnement arsenical chez l'homme résulte souvent de l'ingestion ou de l'inhalation d'un insecticide contenant oxyde arsénieux,...
-
ANTIMOINE
- Écrit par Encyclopædia Universalis et Jean PERROTEY
- 3 876 mots
- 3 médias
...essentiellement par des dérivés organiques, tandis que les composés + III sont les plus nombreux et que la stabilité du degré + V est plus faible que chez l'arsenic. Par l'ensemble de ses propriétés, l'antimoine est très proche de l'arsenic, avec un caractère métallique plus accentué. Le potentiel électrochimique de... -
LÖLLINGITE
- Écrit par Yannick LOZAC'H
- 306 mots
-
MATIÈRE (physique) - État solide
- Écrit par Daniel CALÉCKI
- 8 631 mots
- 12 médias
L'atome d'arsenic possède cinq électrons de valence et trois places vacantes sur sa couche externe. Dans un cristal d'arsenic, chaque atome établit trois liaisons covalentes avec trois atomes premiers voisins. Ces liaisons forment un trièdre, l'angle entre deux liaisons étant égal à 92,8... -
OLIGOÉLÉMENTS
- Écrit par Jean LAVOLLAY
- 3 577 mots
- 1 média
- Afficher les 9 références