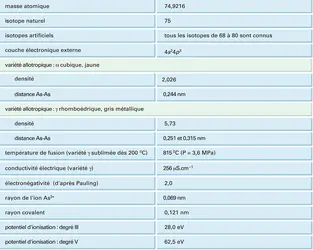
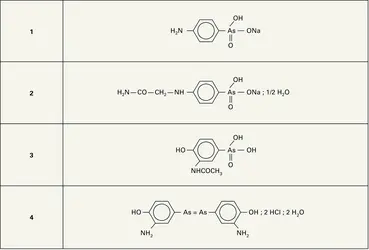
ARSENIC
Article modifié le
Préparation et utilisations
L'arsenic blanc est un sous-produit de la calcination des minerais de cuivre et de plomb. La préparation de l'arsenic élémentaire ne pose pas de problème car la réduction des composés oxygénés ou sulfurés ainsi que la purification se font sans difficulté. Le réalgar est chauffé directement avec du cyanure de potassium qui se transforme en thiocyanate :

Les composés arsenicaux, outre leur intérêt thérapeutique, ont servi de pesticides (arséniates de calcium et de cuivre), qui ont pollué et contaminé l’environnement. L’arsenic est à présent utilisé sur les tambours des imprimantes lasers des photocopieuses et fax. Les alliages d’arsenic et de gallium ou d’indium fournissent des semiconducteurs pour les cellules photovoltaïques, des diodes électroluminescentes et des transistors à très haute fréquence. Enfin, l'arsenic entre dans la composition des plombs de chasse auxquels il confère de la dureté.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean PERROTEY : docteur ès sciences, maître assistant à l'université de Haute-Normandie
Classification
Médias
Autres références
-
ARSENIC, toxicologie
- Écrit par Encyclopædia Universalis
- 255 mots
L'arsenic entrait autrefois dans la composition de nombreux produits insecticides, raticides, pesticides comme de certaines peintures, papiers peints et céramiques.
L'empoisonnement arsenical chez l'homme résulte souvent de l'ingestion ou de l'inhalation d'un insecticide contenant oxyde arsénieux,...
-
ANTIMOINE
- Écrit par Encyclopædia Universalis et Jean PERROTEY
- 3 876 mots
- 3 médias
...essentiellement par des dérivés organiques, tandis que les composés + III sont les plus nombreux et que la stabilité du degré + V est plus faible que chez l'arsenic. Par l'ensemble de ses propriétés, l'antimoine est très proche de l'arsenic, avec un caractère métallique plus accentué. Le potentiel électrochimique de... -
LÖLLINGITE
- Écrit par Yannick LOZAC'H
- 306 mots
-
MATIÈRE (physique) - État solide
- Écrit par Daniel CALÉCKI
- 8 631 mots
- 12 médias
L'atome d'arsenic possède cinq électrons de valence et trois places vacantes sur sa couche externe. Dans un cristal d'arsenic, chaque atome établit trois liaisons covalentes avec trois atomes premiers voisins. Ces liaisons forment un trièdre, l'angle entre deux liaisons étant égal à 92,8... -
OLIGOÉLÉMENTS
- Écrit par Jean LAVOLLAY
- 3 577 mots
- 1 média
- Afficher les 9 références
Voir aussi