ASTROCHIMIE
Le milieu interstellaire
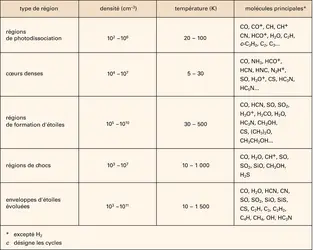
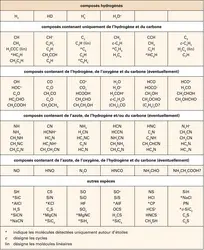
Avec ses 99,999 p. 100 d'hydrogène et d'hélium, le gaz interstellaire est une mixture fort homogène. L'essentiel des éléments chimiques, fabriqués par les étoiles – à commencer par le carbone, l'azote et l'oxygène –, n'y sont présents que dans un rapport d'au mieux 3 pour 10 000 avec l'hydrogène. D'autres éléments – comme le silicium, le soufre, le phosphore, etc. – sont encore moins abondants. Il s'ensuit que la molécule la plus répandue dans l'espace interstellaire est le dihydrogène H2, et que toutes les autres molécules (tabl. 1) ne sont présentes qu'à l'état de traces dans le gaz. Avec des abondances infimes – entre 100 parties par million (ppm) pour le monoxyde de carbone CO et moins d'une partie par milliard pour les longues chaînes carbonées des cyanopolyynes –, la variété des espèces observées dans l'espace illustre malgré tout la richesse de la chimie du milieu interstellaire. Son caractère atypique est, quant à lui, souligné par le fait que les molécules interstellaires sont insaturées malgré la grande quantité d'hydrogène présente dans l'espace. Peu de molécules saturées en hydrogène (le méthane CH4 par exemple) ont été identifiées, et ces espèces sont souvent moins abondantes que les molécules insaturées de même taille. Cette particularité est une conséquence directe des processus qui régissent l'étonnante chimie du cosmos.
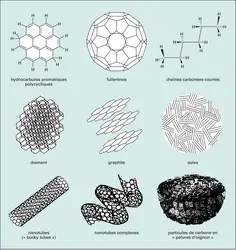
Les conditions de température, de densité et d'éclairement qui règnent entre les étoiles sont en effet très différentes de celles que nous connaissons sur Terre (tabl. 2). Alors que l'on dénombre 2,7 × 1019 particules dans un centimètre cube d'air à la surface de notre planète, on en compte au mieux quelques milliards dans les régions les plus denses de l'environnement interstellaire. Cette très faible densité interdit certaines réactions chimiques et laisse donc à d'autres le loisir de s'exprimer. Le rayonnement stellaire, notamment celui des astres les plus lumineux, joue lui aussi un rôle déterminant dans la synthèse moléculaire. Tandis que nous sommes protégés des émissions ultraviolettes du Soleil par notre atmosphère dense (et en particulier par sa couche d'ozone), le gaz situé entre les étoiles est directement exposé à leurs radiations destructrices. Certaines régions de l'espace, autoprotégées par des mécanismes inopérants sur Terre, sont pourtant totalement opaques à ces radiations. La température y est alors d'environ — 260 0C et une riche « chimie du froid » s'y développe. Cette chimie bien particulière donne naissance à des espèces caractéristiques, comme les cyanopolyynes et l'ammoniac. Ailleurs – sur la surface éclairée des nuages interstellaires denses, par exemple –, on observe plutôt des hydrocarbures, dont les mystérieux PAH (hydrocarbures aromatiques polycycliques), qui contiennent plusieurs centaines d'atomes. Dans les zones où le gaz interstellaire est soudainement comprimé pour une raison ou une autre (régions de chocs), le gaz chauffé à plusieurs centaines de degrés contient en général les molécules SiO et la vapeur d'eau. Enfin, dans le milieu interstellaire diffus (environ 100 particules par centimètre cube et une température de — 160 0C), des hydrocarbures simples subsistent malgré les conditions de rayonnement. On s'aperçoit donc que les chemins de la synthèse moléculaire dans l'espace sont variés. Il existe cependant un dénominateur commun aux espèces détectées dans le milieu interstellaire : elles contiennent pratiquement toutes du carbone. Comme la chimie de la vie, la chimie de l'Univers repose en effet sur cet élément.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- David FOSSÉ : journaliste scientifique
- Maryvonne GERIN : chercheur au Laboratoire d'étude du rayonnement et de la matière en astrophysique (L.E.R.M.A.), C.N.R.S., Observatoire de Paris, École normale supérieure et université de Paris-VI-Pierre-et-Marie-Curie
Classification
Médias
Autres références
-
ALMA (Atacama Large Millimeter/submillimeter Array)
- Écrit par Pierre LÉNA
- 2 129 mots
- 5 médias
La chimie interstellaire est pratiquement née avec la radioastronomie millimétrique dans les années 1980. Avec A.L.M.A., elle entre dans une nouvelle phase, puisque des molécules peuvent être détectées dans tous les types d'objets, en particulier à très grande distance. La complexité des échanges... -
COMÈTES
- Écrit par Myriam DÉTRUY
- 4 348 mots
- 7 médias
Les comètes s'étant formées dans des environnements froids, à des températures inférieures à –170 0C, elles ont subi peu de modifications chimiques, sauf à leur surface si elles ont été bombardées par des rayons ultraviolets ou des protons cosmiques. Les plus gros objets ont peut-être... -
ÉTOILES
- Écrit par André BOISCHOT et Jean-Pierre CHIÈZE
- 13 460 mots
- 8 médias
La formation des molécules dans un nuage peut conduire à sa fragmentation. Les molécules ne peuvent se former que lorsque la densité, à la suite de la contraction globale du nuage, a atteint une valeur suffisamment élevée (plusieurs atomes par mètre cube). La formation de molécules comme H... -
INTERSTELLAIRE MILIEU
- Écrit par James LEQUEUX
- 3 699 mots
- 4 médias
...peu ou pas d'hydrogène atomique (détectable par la raie à 21 cm), mais il n'est malheureusement observable que dans des circonstances exceptionnelles. Contrairement à la plupart des autres molécules, celles d'hydrogène ne peuvent se former à partir des atomes d'hydrogène que par catalyse sur les grains.... - Afficher les 7 références