ASTROCHIMIE
La chimie sur les grains de poussière interstellaire
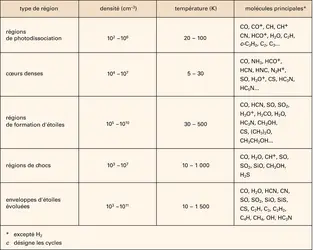
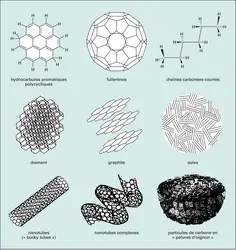
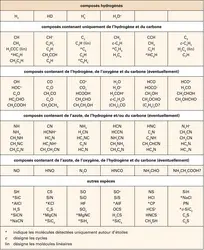
En plus des PAH, il existe dans l'espace toute une gamme de particules solides contenant du carbone. Fullerènes, graphite, suies, nanotubes et même diamants (de quelques nanomètres) constituent probablement une partie des poussières interstellaires (cf. figure). Les grains de silicates, formés dans les enveloppes d'étoiles en fin de vie, riches en oxygène, sont au moins aussi importants. Le rôle des grains de poussière ne se limite pas à protéger les molécules interstellaires du rayonnement ultraviolet des étoiles. Ils jouent aussi un rôle actif dans la chimie et la thermodynamique du milieu. Dans les nuages sombres et froids, aux températures voisines du zéro absolu, les conditions sont favorables à la condensation de molécules du gaz à la surface des grains de poussière. Des manteaux de glaces se forment, constitués principalement d'eau, puis de monoxyde de carbone et de dioxyde de carbone (chacun comptant pour environ 25 p. 100 de la glace d'eau). D'autres espèces chimiques comme le méthanol, le méthane, l'acide formique ou le formaldéhyde sont présentes en petites quantités (quelques pour-cents de la glace d'eau). Contrairement à ce qu'on observe dans le gaz, les espèces saturées sont ici plus abondantes que les radicaux. C'est que la formation des glaces – comme l'ont confirmé les observations du satellite I.S.O. – ne résulte pas seulement de la condensation des molécules du gaz, mais aussi de la transformation des molécules condensées par des réactions chimiques dans la phase solide. Le méthanol CH3OH provient par exemple de la rencontre du monoxyde de carbone (CO) avec des atomes d'hydrogène qui se déplacent à la surface des grains. Ce processus d'hydrogénation explique la prévalence des espèces saturées dans les glaces interstellaires. C'est aussi par un phénomène de condensation et de migration (d'atomes d'oxygène cette fois-ci) qu'on explique la formation du dioxyde de carbone à partir de la molécule CO. Et c'est encore cette même chimie en phase solide qui explique la présence du dihydrogène dans l'espace interstellaire : la plus abondante molécule de l'Univers ne peut pas se former efficacement dans le gaz ! Les atomes d'hydrogène condensés sur les grains ne sont pas complètement figés mais se déplacent à la surface. Quand deux atomes d'hydrogène se rencontrent, la formation de la molécule libère suffisamment d'énergie pour permettre sa sublimation : H2 est libéré dans le gaz. Racontée ici dans ses grandes lignes, la formation du dihydrogène reste en réalité assez mystérieuse. Elle est l'objet de plusieurs expériences de laboratoire.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- David FOSSÉ : journaliste scientifique
- Maryvonne GERIN : chercheur au Laboratoire d'étude du rayonnement et de la matière en astrophysique (L.E.R.M.A.), C.N.R.S., Observatoire de Paris, École normale supérieure et université de Paris-VI-Pierre-et-Marie-Curie
Classification
Médias
Autres références
-
ALMA (Atacama Large Millimeter/submillimeter Array)
- Écrit par Pierre LÉNA
- 2 129 mots
- 5 médias
La chimie interstellaire est pratiquement née avec la radioastronomie millimétrique dans les années 1980. Avec A.L.M.A., elle entre dans une nouvelle phase, puisque des molécules peuvent être détectées dans tous les types d'objets, en particulier à très grande distance. La complexité des échanges... -
COMÈTES
- Écrit par Myriam DÉTRUY
- 4 348 mots
- 7 médias
Les comètes s'étant formées dans des environnements froids, à des températures inférieures à –170 0C, elles ont subi peu de modifications chimiques, sauf à leur surface si elles ont été bombardées par des rayons ultraviolets ou des protons cosmiques. Les plus gros objets ont peut-être... -
ÉTOILES
- Écrit par André BOISCHOT et Jean-Pierre CHIÈZE
- 13 460 mots
- 8 médias
La formation des molécules dans un nuage peut conduire à sa fragmentation. Les molécules ne peuvent se former que lorsque la densité, à la suite de la contraction globale du nuage, a atteint une valeur suffisamment élevée (plusieurs atomes par mètre cube). La formation de molécules comme H... -
INTERSTELLAIRE MILIEU
- Écrit par James LEQUEUX
- 3 699 mots
- 4 médias
...peu ou pas d'hydrogène atomique (détectable par la raie à 21 cm), mais il n'est malheureusement observable que dans des circonstances exceptionnelles. Contrairement à la plupart des autres molécules, celles d'hydrogène ne peuvent se former à partir des atomes d'hydrogène que par catalyse sur les grains.... - Afficher les 7 références