ASTROCHIMIE
Article modifié le
Glaces et formation d'étoiles : vers les molécules complexes
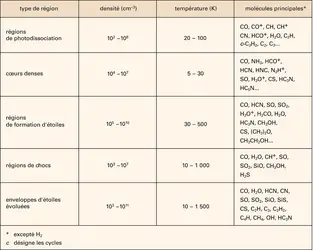
Ces synthèses en phase solide interviennent dans les régions denses et froides, protégées du rayonnement externe, et parallèlement aux réactions chimiques de la phase gazeuse. La croissance des manteaux de glaces sur les grains influence la composition du gaz qui, en se contractant, va finalement former une ou plusieurs étoiles.
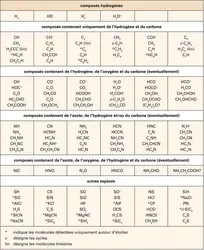
Il est nécessaire de faire un rappel sur le fractionnement isotopique et la chimie du froid. La synthèse d'une molécule à partir de réactions entre ions et molécules passe par la formation d'un ion moléculaire puis la recombinaison de ce dernier avec un électron. Lorsque, au lieu de rencontrer un électron, les ions moléculaires réagissent avec des molécules neutres abondantes, ils se fragmentent le plus souvent et la synthèse avorte. Ce mécanisme est le principal agent de destruction des ions moléculaires dans les nuages sombres, où la photodissociation est négligeable. Les manteaux de glaces jouent alors un rôle passif dans la chimie du gaz interstellaire en captant les espèces les plus abondantes, limitant ainsi la destruction des ions. Dans les régions les plus opaques et les plus denses des nuages sombres, on observe en effet de nombreux ions moléculaires (N2H+ par exemple) et des molécules enrichies en deutérium (NH2D). Il s'agit à première vue d'un paradoxe : aux très basses températures qui règnent dans ces cœurs denses, presque toutes les molécules sont censées être condensées sur les grains et ne peuvent donc pas participer à la chimie du gaz. En fait, des calculs théoriques montrent que, si les molécules les plus abondantes sont condensées sur les grains, le taux de destruction des ions moléculaires est suffisamment affaibli pour leur permettre de prospérer. L'enrichissement en deutérium – jusqu'à un facteur 10 000 – découle quant à lui naturellement de cette abondance d'ions moléculaires. Comment ? On trouve en petites quantités l'agrégat d'hydrogène H3+ au cœur des nuages sombres. Cet agrégat peut réagir avec la molécule d'hydrogène deutérié HD pour former l'ion H2D+. La substitution de l'hydrogène par le deutérium est rapide à basse température. H2D+ peut ensuite soit se combiner à un électron (pour créer H2), soit réagir avec une molécule pour transmettre son atome de deutérium. Les électrons étant peu abondants au sein des nuages sombres et la transmission du deutérium étant efficace, on atteint rapidement des taux d'enrichissement considérables. On a ainsi détecté de l'ammoniac trois fois deutérié, ND3, dans un nuage interstellaire. Cet enrichissement n'est bien entendu possible que si les ions moléculaires ne sont pas détruits dès le départ par les molécules les plus abondantes. La croissance des manteaux de glace, où elles se condensent, coopère donc pleinement avec la chimie en phase gazeuse pour favoriser un enrichissement maximal des molécules en deutérium.
Ces processus vont peser considérablement sur la chimie du nuage hôte. En effet, le rayonnement intense des toutes jeunes étoiles réchauffe le gaz et la poussière alentour, tandis que les vents de ces étoiles provoquent des ondes de chocs. Les manteaux de glace se désagrègent et s'évaporent alors en libérant leurs molécules organiques simples. Sous l'effet conjugué du réchauffement du gaz – qui constitue un apport d'énergie pour les molécules – et de l'afflux de nouvelles espèces, la chimie s'emballe. Le choix des réactions chimiques n'est cette fois plus limité et des molécules complexes se forment, parmi lesquelles l'acétone (CH3)2CO, l'alcool éthylique et, peut-être, des acides aminés. À ce stade, la question du lien entre cette chimie interstellaire et notre système solaire, voire notre propre planète, se pose. À deux[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- David FOSSÉ : journaliste scientifique
- Maryvonne GERIN : chercheur au Laboratoire d'étude du rayonnement et de la matière en astrophysique (L.E.R.M.A.), C.N.R.S., Observatoire de Paris, École normale supérieure et université de Paris-VI-Pierre-et-Marie-Curie
Classification
Médias
Autres références
-
ALMA (Atacama Large Millimeter/submillimeter Array)
- Écrit par Pierre LÉNA
- 2 129 mots
- 5 médias
La chimie interstellaire est pratiquement née avec la radioastronomie millimétrique dans les années 1980. Avec A.L.M.A., elle entre dans une nouvelle phase, puisque des molécules peuvent être détectées dans tous les types d'objets, en particulier à très grande distance. La complexité des échanges... -
COMÈTES
- Écrit par Myriam DÉTRUY
- 4 348 mots
- 7 médias
Les comètes s'étant formées dans des environnements froids, à des températures inférieures à –170 0C, elles ont subi peu de modifications chimiques, sauf à leur surface si elles ont été bombardées par des rayons ultraviolets ou des protons cosmiques. Les plus gros objets ont peut-être... -
ÉTOILES
- Écrit par André BOISCHOT et Jean-Pierre CHIÈZE
- 13 460 mots
- 8 médias
La formation des molécules dans un nuage peut conduire à sa fragmentation. Les molécules ne peuvent se former que lorsque la densité, à la suite de la contraction globale du nuage, a atteint une valeur suffisamment élevée (plusieurs atomes par mètre cube). La formation de molécules comme H... -
INTERSTELLAIRE MILIEU
- Écrit par James LEQUEUX
- 3 699 mots
- 4 médias
...peu ou pas d'hydrogène atomique (détectable par la raie à 21 cm), mais il n'est malheureusement observable que dans des circonstances exceptionnelles. Contrairement à la plupart des autres molécules, celles d'hydrogène ne peuvent se former à partir des atomes d'hydrogène que par catalyse sur les grains.... - Afficher les 7 références
Voir aussi