- 1. L’atmosphère : un mélange d’air sec et de vapeur d’eau
- 2. L’atmosphère considérée comme un gaz parfait
- 3. La vapeur d’eau atmosphérique et ses transformations
- 4. Thermodynamique et mouvements verticaux des parcelles
- 5. Stabilité et instabilités de l’atmosphère
- 6. Les transferts de chaleur par convection thermique : cellules convectives
- 7. Bibliographie
ATMOSPHÈRE Thermodynamique
Article modifié le
La vapeur d’eau atmosphérique et ses transformations
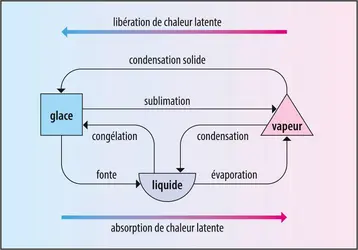
Dans l’atmosphère terrestre, l’eau peut se présenter sous trois états :
– la vapeur, état dans lequel les molécules ont des mouvements très désordonnés et s’agitent à grandes vitesses (à titre d’exemple, leur vitesse moyenne est d’environ 2 300 km/h pour une température ambiante de 20 0C) ;
– le liquide, dans lequel les molécules sont liées entre elles, sans toutefois pouvoir établir de structures rigides ;
– la glace, dans laquelle les molécules ont des liens forts et des possibilités de déplacement limitées.
Physique des changements d’état de l’eau
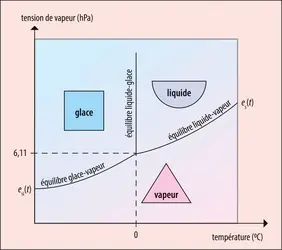
Lorsque la tension de vapeur e atteint une valeur es, dite tension de vapeur saturante, les échanges à l’interface entre de la vapeur et du liquide sont équilibrés, la vapeur ne peut pas accueillir plus de molécules qu’elle n’en contient déjà, on dit qu’elle est saturée par rapport à l’eau liquide – ce qui correspond à une humidité relative HU(p. 100) = 100 e/es = 100 p. 100. Il en est de même pour l’équilibre à l’interface entre de la vapeur et de la glace qui est atteint pour des valeurs de e égales à esi, dite tension de vapeur saturante par rapport à la glace. La valeur des tensions de vapeur saturante ne dépend que de la température. Pour des températures (t) comprises entre – 30 0C et + 35 0C, l’équation , où t est exprimée en degrés Celsius, donne une valeur de es(t) en hPa, approchée à moins de 0,1 p. 100. À partir de ces valeurs, tout refroidissement, comme tout apport supplémentaire de molécules dans la vapeur, devrait se traduire aussitôt par un transfert de molécules vers le liquide (condensation) ou vers la glace (condensation solide) et, à l’inverse, tout réchauffement, comme toute perte de molécules dans la vapeur, devrait se traduire par un transfert de molécules depuis le liquide (évaporation), ou depuis la glace (sublimation), vers la vapeur pour tenter de la saturer.
De son côté, aux pressions rencontrées dans l’atmosphère, l’équilibre entre de l’eau liquide et de la glace se produit à une température de 0 0C. À ce stade, tout refroidissement devrait se traduire aussitôt par un transfert de molécules du liquide vers la glace (congélation ou solidification) et tout réchauffement par un transfert inverse (fonte ou fusion).
Lorsque, dans de telles transformations, certaines molécules rejoignent des structures plus organisées (condensation, condensation solide, congélation), elles cèdent une partie de leur énergie (libération de chaleur latente) ce qui se traduit par un fort réchauffement de leur environnement. À l’inverse, pour rompre les liens qui les associent à leurs voisines, les molécules, qui s’échappent vers des états moins ordonnés (évaporation, sublimation, fonte), puisent de l’énergie dans leur environnement, ce qui entraîne un fort refroidissement du milieu qu’elles abandonnent. Ainsi, lorsqu’on est mouillé après avoir transpiré ou être resté sous une averse, notre corps se refroidit parce qu’il fournit l’énergie nécessaire à l’évaporation des molécules d’eau liquide qui le recouvrent.
La chaleur libérée ou absorbée lors de ces divers changements d’état est considérable. Un seul kilogramme d’eau libère (ou absorbe) environ 2,5 millions de joules par condensation (ou évaporation), environ 300 000 joules par congélation (ou fonte) et 2,8 millions de joules (soit la somme des énergies mises en jeu dans les deux précédentes transformations) par condensation solide (sublimation), ce qui correspond à l’énergie nécessaire pour faire fonctionner une ampoule de 30 watts pendant plus de vingt-quatre heures.
Sursaturation et surfusion dans les changements d’état de l’eau
La situation est toutefois légèrement différente lorsqu’on est initialement en présence d’une seule phase de l’eau et que les molécules[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean-Pierre CHALON : ingénieur général des ponts, des eaux et des forêts honoraire
Classification
Médias
Autres références
-
ACCÉLÉROMÈTRES SPATIAUX
- Écrit par Raphaël F. GARCIA et Pierre TOUBOUL
- 4 883 mots
- 3 médias
...mouvements du sol à la frontière entre l'atmosphère et l'espace. En effet, comme le gradiomètre permet de mesurer les accélérations ressenties par le satellite, il est sensible aux variations de densité de l'air ainsi qu'aux déplacements des couches atmosphériques qui exercent une pression sur le satellite.... -
AÉRONOMIE
- Écrit par Gaston KOCKARTS
- 4 158 mots
- 11 médias
L' aéronomie a pour objet l'étude des régions atmosphériques où les phénomènes de dissociations moléculaires et d'ionisation sont importants. Cette définition s'applique aussi bien à l'atmosphère terrestre qu'aux atmosphères planétaires. Le mot aéronomie fut imaginé par Sidney Chapman (1888-1970) et...
-
AIR
- Écrit par Jean PERROTEY
- 2 155 mots
- 2 médias
Le globe terrestre est entouré d'une atmosphère constituée d'un mélange gazeux nommé air, qui s'étend de la surface du sol jusqu'à une altitude d'environ 150 kilomètres.
La pression de l'air au niveau de la mer a longtemps servi d'unité de pression (atmosphère) ; elle...
-
ANTARCTIQUE
- Écrit par Pierre CARRIÈRE , Edmond JOUVE , Jean JOUZEL , Gérard JUGIE et Claude LORIUS
- 16 485 mots
- 24 médias
...la circulation atmosphérique. Enfin, on a observé pour la première fois une corrélation directe entre l'évolution de la température et la teneur de l' atmosphère en gaz carbonique, les périodes les plus chaudes étant associées à des teneurs plus élevées et vice versa. En ce qui concerne l'époque récente,... - Afficher les 73 références
Voir aussi
- ÉNERGIE SOLAIRE
- ÉVAPORATION, hydrologie
- CONVECTION ou CONVEXION
- RAYONNEMENT SOLAIRE
- ISOBARE
- STRATOSPHÈRE & STRATOPAUSE
- STABILITÉ, météorologie
- TEMPÉRATURE, météorologie et climatologie
- PLUIE
- TEMPÉRATURE POTENTIELLE
- GELÉE
- GIVRE
- CUMULUS
- CONDENSATION, météorologie
- ROSÉE
- GAZ PARFAITS LOI DES
- HYGROMÉTRIE
- VAPEUR D'EAU
- TENSION DE VAPEUR
- BRISES DE TERRE ET DE MER
- ADIABATIQUE TRANSFORMATION
- ÉNERGIE THERMIQUE
- THERMODYNAMIQUE DE L'ATMOSPHÈRE
- TRANSFORMATIONS THERMODYNAMIQUES
- PRESSION PARTIELLE
- HUMIDITÉ RELATIVE