ATOME
Article modifié le
Atome et spectroscopie
L'étude des spectres des éléments et des corps composés constitue la source essentielle des informations sur la structure quantique des atomes et des molécules. Cette étude repose sur la détermination de la fréquence des raies spectrales qui correspondent à des transitions entre états quantiques, à quoi s'ajoutent la détermination de l'intensité des raies et la considération des règles de sélection qui déterminent les transitions permises et les transitions interdites.
Dans l' équation de Schrödinger d'un atome formé d'un noyau de Z électrons, de charge Ze et de masse M, l'opérateur hamiltonien a la forme :


Dans le cas le plus simple (celui de l'atome d' hydrogène), cette équation peut être décomposée en deux équations, la première représentant le mouvement libre du centre de masse de l'atome, la seconde :

Dans une équation telle que (8), dont l'hamiltonien possède une symétrie sphérique, on peut séparer la partie de la fonction de Schrödinger qui donne une représentation du groupe des rotations, l'harmonique sphérique Ylm (θ, ϕ) de la partie radiale Rnl (r) qui dépend du potentiel :


Les nombres l et m déterminent respectivement les valeurs propres des opérateurs qui représentent le carré du moment angulaire orbital de l'électron &arL ; :
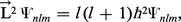
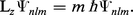
La condition imposée sur la fonction d'état (9), à savoir qu'elle doit être régulière en tout point et convergente quand r → ∞, de sorte que l'intégrale :


Cette formule est exactement celle (6) qui a été déduite par Bohr au moyen de son modèle, et qui fut vérifiée expérimentalement par Franck et Hertz.
On trouve que l'atome peut subir une transition entre un état défini par les nombres n, l, m et un autre état déterminé par les nombres n′, l′, m′, sous la condition que la variation de l, Δl = l′ — l, soit égale à ± 1 et celle de m, Δm = m′ — m, soit 0, + 1 ou — 1 :




Les valeurs propres de cet opérateur sont précisément de la forme (— 1)l ; (— 1)l est la parité de l'état Ψnlm. La parité d'un état doit donc changer dans une transition permise.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- José LEITE LOPES : professeur de physique nucléaire, université Louis-Pasteur, directeur du groupe physique théorique et hautes énergies du Centre de recherche nucléaire de Strasbourg
Classification
Médias
Autres références
-
ATOME, notion d'
- Écrit par Bernard PIRE
- 1 499 mots
« Brique insécable » de la matière selon son étymologie, l'atome est le terme ultime de la division de la matière dans lequel les éléments chimiques conservent leur individualité. C'est la plus petite particule d'un élément qui existe à l'état libre ou combiné, les corps simples étant...
-
DESCRIPTION DE L'ATOME
- Écrit par Bernard PIRE
- 104 mots
Ernest Rutherford (1871-1937) propose en 1911 un modèle planétaire de l'atome. L'interprétation des résultats expérimentaux obtenus par ses collaborateurs Hans Geiger et Ernest Marsden sur la déviation violente des rayons α une mince feuille d'or lui permet de comprendre qu'un atome est...
-
AGRÉGATS, physico-chimie
- Écrit par Jean FARGES et Rémi JULLIEN
- 1 616 mots
- 7 médias
...nombreuses méthodes physiques utilisées, la spectrométrie de masse est la plus importante. Elle permet en effet de classer les agrégats selon le nombre N d'atomes ou de molécules qu'ils contiennent. Ainsi, les spectres de masses, pour certaines valeurs de N appelées « nombres magiques », font apparaître... -
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 363 mots
- 5 médias
La seconde voie non expérimentale est celle de la théorie physique de l'état solide.Les atomes interagissent entre eux par l'intermédiaire de leurs couches électroniques externes, lesquelles sont bien décrites par la mécanique quantique. Des modèles des alliages ont été construits pour essayer,... -
BOHR ATOME DE
- Écrit par Bernard PIRE
- 369 mots
- 1 média
Deux ans après avoir soutenu sa thèse sur la théorie électronique des métaux, le physicien danois Niels Bohr (1885-1962) écrit en 1913 trois articles fondamentaux qui révolutionnent la compréhension de la structure de la matière. Le premier, paru le 5 avril dans le Philosophical Magazine...
-
ATOME HABILLÉ
- Écrit par Bernard CAGNAC
- 424 mots
La théorie de l'« atome habillé » est une méthode de mécanique quantique permettant de calculer de manière simple et facile à interpréter les phénomènes qui se produisent lorsqu'un atome interagit avec un champ électromagnétique très intense résonnant ou voisin d'une résonance...
- Afficher les 87 références
Voir aussi
- FRÉQUENCE, physique
- ONDE ou RAYONNEMENT ÉLECTROMAGNÉTIQUE
- ABSORPTION, physique
- ISOTOPES
- POSITONIUM ou POSITRONIUM
- ORBITALES ATOMIQUES
- NOYAU ATOMIQUE
- INTERACTIONS MOLÉCULAIRES
- ÉMISSION, physique
- HAMILTONIEN
- SCHRÖDINGER ÉQUATION DE
- CRISTAL IONIQUE
- AVOGADRO LOI D'
- GAY-LUSSAC LOI DE
- SCIENCES HISTOIRE DES, XIXe s.
- MÉCANIQUE ONDULATOIRE
- MUONS
- EXCITATION, physique
- CHARGE ÉLECTRIQUE
- QUANTIQUES NOMBRES
- TRANSITION, physique
- COVALENTE LIAISON
- FONCTION D'ONDE
- COUCHES ÉLECTRONIQUES
- ÉNERGIE POTENTIELLE
- SCIENCES HISTOIRE DES, Antiquité et Moyen Âge
- BREMSSTRAHLUNG ou RAYONNEMENT DE FREINAGE
- ÉMISSION SPONTANÉE
- ÉMISSION STIMULÉE ou ÉMISSION INDUITE
- HÉLIUM
- ÉLÉMENTS CHIMIQUES
- PROPORTIONS LOI DES, chimie
- QUANTIQUE MÉCANIQUE
- PAULI PRINCIPE D'EXCLUSION DE
- POSITONS ou POSITRONS
- SOLIDES PHYSIQUE DES
- HEISENBERG RELATIONS DE ou RELATIONS D'INCERTITUDE
- COMMUTATION RELATION DE
- RÈGLES DE SÉLECTION, physique
- ÉLECTRONIQUE STRUCTURE
- FRANCK & HERTZ EXPÉRIENCE DE
- RYDBERG FORMULE DE
- PROBABILITÉ DE TRANSITION
- PÉRIODIQUE CLASSIFICATION
- NIVEAU, physique atomique
- CONFIGURATION ÉLECTRONIQUE
- MUONIUM
- ATOME ARTIFICIEL
- CHIMIE HISTOIRE DE LA
- ATOME EXOTIQUE
- HÉLIUM MUONIQUE
- SPECTRE, optique
- MOMENT CINÉTIQUE ou MOMENT ANGULAIRE
- AVOGADRO NOMBRE D'
- RYDBERG CONSTANTE DE
- RAIE SPECTRALE
- RUTHERFORD ATOME DE
- DUALITÉ ONDE-CORPUSCULE
- LENNARD-JONES POTENTIEL DE
- PHYSIQUE HISTOIRE DE LA
- SCIENCES HISTOIRE DES
- ÉTAT QUANTIQUE







