ATOME
Article modifié le
Atomes et forces atomiques
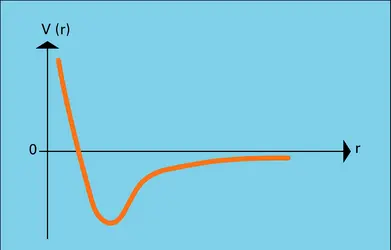
Tous les atomes et molécules neutres, suffisamment éloignés l'un de l'autre, s'attirent avec une force dont l'énergie potentielle varie comme l'inverse de la sixième puissance de la distance mutuelle. Ce sont les forces d'attraction de Van der Waals, responsables de la cohésion des atomes des liquides ou des gaz rares solidifiés, par exemple dans les cristaux moléculaires d'hydrogène solide.
Ces forces résultent de l'action que le système de charges d'un atome ou molécule neutre produit sur celui d'un autre atome ou molécule. La théorie classique a permis une description intuitive des forces d'attraction de Van der Waals ; on a ainsi classé ces interactions en différents types : a) attraction « dipôle-dipôle », qui agit entre les molécules polaires (possédant un moment électrique dipolaire permanent) ; b) attraction « polarisabilité-polarisabilité », entre les atomes et les molécules neutres et symétriques, c'est-à-dire homopolaires ; c) attraction « dipôle-polarisabilité », entre une molécule polaire et un atome sphériquement symétrique.
La théorie complète de ces forces a été formulée en mécanique quantique. Un modèle simple du système des forces de Van der Waals a été développé à cet égard par London. Cet auteur a étudié les forces qui se produisent entre deux oscillateurs linéaires constitués chacun d'une charge négative vibrant autour d'une charge positive très lourde elle-même en repos. Pour des distances entre les centres des deux oscillateurs, R, très grandes en comparaison avec les dimensions de chaque oscillateur, il apparaît que l'énergie du système se compose de la somme des énergies du point zéro des deux oscillateurs et d'un terme additionnel négatif et inversement proportionnel à la sixième puissance de R.
Quand il y a superposition des nuages de charge de deux systèmes atomiques, des forces d'un autre type entrent en action. Dans le cas de deux couches atomiques saturées, fermées, dans le sens du principe de Pauli, qui se superposent, une force de répulsion très intense apparaît : c'est la force de répulsion moléculaire dont l'énergie potentielle, sous la forme dite de Lennard-Jones, pour les molécules sphériques, varie comme l'inverse de la puissance onzième de la distance intermoléculaire.
En raison de l'action des forces d'attraction et de répulsion de Van der Waals, l'énergie potentielle de molécules sphériques est représentée par la courbe de la figure, en fonction de la distance moléculaire.
Quand les fonctions d'onde de deux atomes (à couches électroniques non saturées) entrent en superposition, un autre type de forces agit entre les deux systèmes : ce sont les forces de liaison chimique.
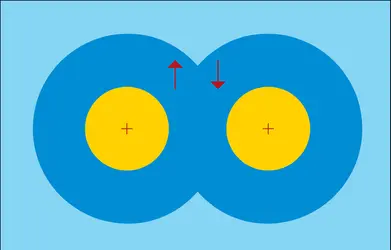
La liaison chimique homopolaire est déterminée par une paire d'électrons tels que chacun de ces corpuscules peut être regardé comme appartenant aux deux systèmes ; si l'énergie du système formé est plus petite que la somme des énergies des deux atomes séparés, le couple d'électrons donnera lieu à une molécule stable. L'exemple le plus simple est celui de la molécule d'hydrogène. Si deux atomes A et B sont très éloignés l'un de l'autre, on peut envisager isolément chacun des électrons de ces atomes. Quand les deux atomes sont très proches, un quelconque de ces deux électrons est attiré non seulement par le noyau de l'atome A mais aussi par celui de l'atome B. On peut alors montrer qu'un tel système peut avoir deux états ; un de ces états, l'état de liaison chimique, possède une énergie qui présente un minimum quand on fait varier la distance entre les deux noyaux A et B. Dans cet état, les deux électrons sont couplés de telle façon que leurs spins sont antiparallèles. On dit que ces spins sont saturés. De cette façon, l'on comprend la définition de la valence d'un atome[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- José LEITE LOPES : professeur de physique nucléaire, université Louis-Pasteur, directeur du groupe physique théorique et hautes énergies du Centre de recherche nucléaire de Strasbourg
Classification
Médias
Autres références
-
ATOME, notion d'
- Écrit par Bernard PIRE
- 1 499 mots
« Brique insécable » de la matière selon son étymologie, l'atome est le terme ultime de la division de la matière dans lequel les éléments chimiques conservent leur individualité. C'est la plus petite particule d'un élément qui existe à l'état libre ou combiné, les corps simples étant...
-
DESCRIPTION DE L'ATOME
- Écrit par Bernard PIRE
- 104 mots
Ernest Rutherford (1871-1937) propose en 1911 un modèle planétaire de l'atome. L'interprétation des résultats expérimentaux obtenus par ses collaborateurs Hans Geiger et Ernest Marsden sur la déviation violente des rayons α une mince feuille d'or lui permet de comprendre qu'un atome est...
-
AGRÉGATS, physico-chimie
- Écrit par Jean FARGES et Rémi JULLIEN
- 1 616 mots
- 7 médias
...nombreuses méthodes physiques utilisées, la spectrométrie de masse est la plus importante. Elle permet en effet de classer les agrégats selon le nombre N d'atomes ou de molécules qu'ils contiennent. Ainsi, les spectres de masses, pour certaines valeurs de N appelées « nombres magiques », font apparaître... -
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 363 mots
- 5 médias
La seconde voie non expérimentale est celle de la théorie physique de l'état solide.Les atomes interagissent entre eux par l'intermédiaire de leurs couches électroniques externes, lesquelles sont bien décrites par la mécanique quantique. Des modèles des alliages ont été construits pour essayer,... -
BOHR ATOME DE
- Écrit par Bernard PIRE
- 369 mots
- 1 média
Deux ans après avoir soutenu sa thèse sur la théorie électronique des métaux, le physicien danois Niels Bohr (1885-1962) écrit en 1913 trois articles fondamentaux qui révolutionnent la compréhension de la structure de la matière. Le premier, paru le 5 avril dans le Philosophical Magazine...
-
ATOME HABILLÉ
- Écrit par Bernard CAGNAC
- 424 mots
La théorie de l'« atome habillé » est une méthode de mécanique quantique permettant de calculer de manière simple et facile à interpréter les phénomènes qui se produisent lorsqu'un atome interagit avec un champ électromagnétique très intense résonnant ou voisin d'une résonance...
- Afficher les 87 références
Voir aussi
- FRÉQUENCE, physique
- ONDE ou RAYONNEMENT ÉLECTROMAGNÉTIQUE
- ABSORPTION, physique
- ISOTOPES
- POSITONIUM ou POSITRONIUM
- ORBITALES ATOMIQUES
- NOYAU ATOMIQUE
- INTERACTIONS MOLÉCULAIRES
- ÉMISSION, physique
- HAMILTONIEN
- SCHRÖDINGER ÉQUATION DE
- CRISTAL IONIQUE
- AVOGADRO LOI D'
- GAY-LUSSAC LOI DE
- SCIENCES HISTOIRE DES, XIXe s.
- MÉCANIQUE ONDULATOIRE
- MUONS
- EXCITATION, physique
- CHARGE ÉLECTRIQUE
- QUANTIQUES NOMBRES
- TRANSITION, physique
- COVALENTE LIAISON
- FONCTION D'ONDE
- COUCHES ÉLECTRONIQUES
- ÉNERGIE POTENTIELLE
- SCIENCES HISTOIRE DES, Antiquité et Moyen Âge
- BREMSSTRAHLUNG ou RAYONNEMENT DE FREINAGE
- ÉMISSION SPONTANÉE
- ÉMISSION STIMULÉE ou ÉMISSION INDUITE
- HÉLIUM
- ÉLÉMENTS CHIMIQUES
- PROPORTIONS LOI DES, chimie
- QUANTIQUE MÉCANIQUE
- PAULI PRINCIPE D'EXCLUSION DE
- POSITONS ou POSITRONS
- SOLIDES PHYSIQUE DES
- HEISENBERG RELATIONS DE ou RELATIONS D'INCERTITUDE
- COMMUTATION RELATION DE
- RÈGLES DE SÉLECTION, physique
- ÉLECTRONIQUE STRUCTURE
- FRANCK & HERTZ EXPÉRIENCE DE
- RYDBERG FORMULE DE
- PROBABILITÉ DE TRANSITION
- PÉRIODIQUE CLASSIFICATION
- NIVEAU, physique atomique
- CONFIGURATION ÉLECTRONIQUE
- MUONIUM
- ATOME ARTIFICIEL
- CHIMIE HISTOIRE DE LA
- ATOME EXOTIQUE
- HÉLIUM MUONIQUE
- SPECTRE, optique
- MOMENT CINÉTIQUE ou MOMENT ANGULAIRE
- AVOGADRO NOMBRE D'
- RYDBERG CONSTANTE DE
- RAIE SPECTRALE
- RUTHERFORD ATOME DE
- DUALITÉ ONDE-CORPUSCULE
- LENNARD-JONES POTENTIEL DE
- PHYSIQUE HISTOIRE DE LA
- SCIENCES HISTOIRE DES
- ÉTAT QUANTIQUE