AZOTE
Article modifié le
Composés
L'hydrazine N2H4
La méthode de préparation habituellement utilisée est l'action de l' ammoniac sur une solution d'hypochlorite. La réaction se fait par l'intermédiaire de la chloramine NH2Cl et mène, mais avec un rendement toujours inférieur à 100 p. 100, au chlorure d'hydrazinium :
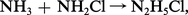
On passe à l'hydrazine hydratée par hydrolyse basique. La déshydratation peut s'effectuer par distillation en présence d'oxyde alcalino-terreux.
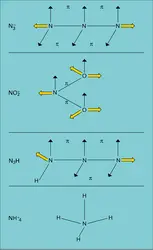
L'hydrazine anhydre, dont la formule structurale peut s'écrire NH2−NH2 avec deux groupements NH2 perpendiculaires et bloqués l'un par rapport à l'autre, est un liquide corrosif et incolore, dont le point de fusion est voisin de 2 0C. Fortement hygroscopique, elle fume à l'air. Un hydrate de composition N2H4, H2O a été isolé.
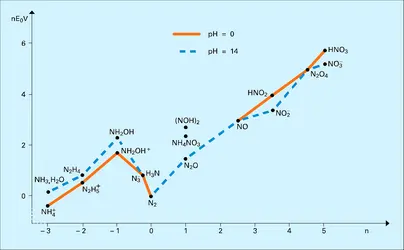
Endothermique, l'hydrazine se décompose soit sous l'effet de catalyseurs appropriés (ions Fe3+ ou Cu2+), soit par élévation de température : la dégradation mène à un mélange d'ammoniac, d'azote et d'hydrogène (la position, dans la figure, de N2H4 par rapport au mélange de composition correspondante 2NH3, N2 est à cet égard significative : l'énergie du second système est inférieure à celle du premier). Cette propriété de N2H4, associée à son caractère réducteur, explique son utilisation comme carburant de propergol, couplée avec l'eau oxygénée (H2O2) ou l'acide nitrique (HNO3). L'instabilité de l'hydrazine permet de comprendre également que certaines réactions d'oxydation soient explosives.
Par suite de son caractère donneur, N2H4 possède des propriétés basiques en solution aqueuse :
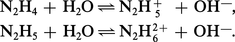
Même la première fonction basique est faible, la structure de N2H4 explique que la basicité soit inférieure à celle de l'ammoniac (la première constante de basicité est de l'ordre de 10-6 au lieu de 10-5).
Ce caractère basique est suffisamment marqué, cependant, pour permettre l'isolement de sels d'hydrazinium, N2H5Cl ou N2H5HSO4 par exemple, beaucoup plus stables que l'hydrazine elle-même.
L'hydrazine donne également des réactions de substitution avec les métaux alcalins, par exemple :

Cette propriété résulte sans doute de l'existence d'une faible dissociation ionique :

La diméthylhydrazine asymétrique NH2 −N(CH3)2 est utilisée comme carburant de fusée, associée à l'acide nitrique fumant. Ce couple constitue un propergol de très haute fidélité.
L'hydroxylamine NH2OH
On l'obtient par action d'un réducteur doux sur les acides oxygénés de l'azote ou encore sur les sels correspondants. Elle se présente sous forme de cristaux blancs de symétrie rhomboédrique, qui fondent vers 32 0C, fortement hygroscopiques et très solubles dans l'eau. Le solide aussi bien que les solutions aqueuses se décomposent progressivement selon des réactions qui diffèrent avec les conditions expérimentales, mais qui mènent toujours à la formation d'ammoniac et d'un composé dans lequel l'azote possède une charge formelle plus élevée, azote ou hémioxyde d'azote N2O par exemple (cf. diagramme, ).
Par suite du caractère fortement électronégatif du groupement OH, l'hydroxylamine est un donneur moins marqué que l'ammoniac ou que l'hydrazine. Ses solutions sont donc moins basiques (la constante de basicité est de l'ordre de 10-9) et les sels d'hydroxylammonium correspondants, NH3(OH)Cl ou [NH3(OH)]2SO4 par exemple, sont beaucoup moins stables à la chaleur que les sels d'ammonium.
Les réactions de réduction (avec le zinc par exemple) ou d'oxydation, par l'oxygène atmosphérique, peuvent être très vives, tant à cause des valeurs des potentiels d'oxydoréduction correspondants que de l'instabilité thermique de NH2OH.
L'acide azothydrique N3H et les azotures[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Paul HAGENMULLER : professeur à la faculté des sciences de Bordeaux, directeur du Laboratoire de chimie du solide au C.N.R.S.
- Encyclopædia Universalis : services rédactionnels de l'Encyclopædia Universalis
Classification
Médias
Autres références
-
AGRICULTURE - Agriculture et industrialisation
- Écrit par François PAPY
- 7 422 mots
- 3 médias
L'intérêt d'un apport d'azote minéral, même en complément du fumier, est apparu au milieu du xixe siècle. Il était alors appliqué sous forme de nitrate de soude (ou salpêtre) en provenance des déserts arides du Chili. Devant l'engouement pour ce produit, des agronomes s'interrogent, dès... -
AIR
- Écrit par Jean PERROTEY
- 2 155 mots
- 2 médias
...de l'oxygène en excès, la présence d'un résidu non absorbable, ce qui constitue la première mise en évidence de l'argon et des gaz rares de l'air. Jusqu'à la fin du xixe siècle, on distingue deux sortes d'azote, l'azote obtenu par la voie chimique, par décomposition du nitrite d'ammonium :... -
AMINES
- Écrit par Jacques METZGER
- 3 235 mots
- 4 médias
Lachimie des trois classes d'amines est caractérisée par la présence, sur l'atome d'azote, d'un doublet non partagé qui confère à la molécule des propriétés basiques et une réactivité nucléophile. Les amines primaires et secondaires présentent en outre une réactivité particulière, liée à la présence... -
AMMONIAC
- Écrit par Henri GUÉRIN
- 5 035 mots
- 5 médias
...solution aqueuse du gaz ammoniac, fut proposé par Torbern Olof Bergmann. Priestley avait été amené à considérer ce gaz comme un composé d' azote et d'hydrogène ; cela fut confirmé par Claude Louis Berthollet, qui, en 1785, en fit l'analyse et indiqua sa composition ; celle-ci correspond... - Afficher les 26 références
Voir aussi
- BASE, chimie
- ISOTOPES
- MONOXYDE D'AZOTE
- MINÉRALE CHIMIE
- OXYDORÉDUCTION
- DIOXYDE D'AZOTE
- POTENTIEL D'OXYDORÉDUCTION
- ANHYDRIDES
- CYANAMIDE CALCIQUE
- HYBRIDATION DES ORBITALES
- NITRURES
- OXYNITRURES
- NITRITES
- ENDOTHERMIQUE RÉACTION
- AMIDURES
- HYDRAZINE
- DIMÉTHYLHYDRAZINE
- HYDROXYLAMINE
- FULMINANTS
- AZOTHYDRIQUE ACIDE
- AZOTURES
- NITRATE D'AMMONIUM
- OXYDES D'AZOTE
- ÉLECTRONIQUE STRUCTURE
- PROTOXYDE ou HÉMIOXYDE D'AZOTE
- CONFIGURATION ÉLECTRONIQUE
- TRANSITION MÉTAUX DE
- NITREUX ACIDE
- OXYDES