BENZÈNE
Article modifié le
Le plus simple des hydrocarbures aromatiques.
Formule : C6H6

Fréquemment symbolisé par :

Masse moléculaire : 78,11 g
Masse spécifique : 0,88 g/cm3
Point de fusion : 5,5 0C
Point d'ébullition : 80,09 0C.
Cristaux incolores dans le système orthorhombique bipyramidal. Forme un azéotrope avec l'eau. Infiniment soluble dans l'éthanol, l'éther, l'acide acétique, l'acétone et le toluène.
Le benzène est le composé aromatique idéal. Il réunit en effet toutes les conditions d'aromaticité : selon la formule de Kekulé, tous les carbones présentent une hybridation sp2, d'où délocalisation des électrons qui circulent sur les six sommets et planéité du cycle. Le benzène montre une stabilité exceptionnelle ; il bénéficie d'une énergie de résonance En importante égale à 36,6 kcal/mole. Il semble que ce nombre de six électrons π permet la stabilité du cycle ; en fait, Hückel a montré que les cycles présentent un caractère aromatique s'il y a (4 n + 2) électrons π. Le caractère aromatique du benzène lui confère des propriétés particulières : les réactions d'addition sont difficiles, car il faut fournir une grande énergie (supérieure à 36,6 kcal) pour rompre l'aromaticité du cycle. L'addition en bloc de trois molécules d'hydrogène ou d'halogène est possible, car on sature alors tout le système. Les réactions d'oxydation sont difficiles.
En revanche, le benzène présente de nombreuses possibilités de substitution électrophiles, car ces substitutions restituent l'aromaticité du cycle.
De la même façon, le benzène peut donner lieu à une réaction de nitration (en présence d'un mélange HNO3, H2SO4) ou à une réaction de sulfonation (en présence d'oléum), ainsi qu'à toute une classe de réactions de substitution, dites réactions de Friedel et Crafts : il s'agit de la substitution d'un hydrogène par un groupement alcoyle R— ou par un groupement acyle R—CO — en présence de chlorure d'aluminium ; il y a ensuite attaque du noyau par le carbocation R—O ou R—C = O—O.
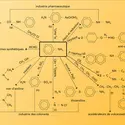
Le benzène existe dans presque tous les pétroles et se forme au cours de nombreuses réactions de pyrogénation (on le trouve alors dans le gaz d'éclairage, dans le goudron de houille et dans les produits de distillation d'essences de térébenthine). On l'obtient aussi industriellement de la rectification des huiles légères ou du débenzolage du gaz par les huiles lourdes. C'est un dissolvant employé dans l'industrie des laques et du caoutchouc ; on l'utilise comme solvant dans de nombreuses réactions. Le benzène est un produit de base pour la synthèse de nombreux composés (phénol, aniline, etc.). Il est d'autant plus toxique qu'il s'accumule dans l'organisme.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Dina SURDIN : auteur
Classification
Autres références
-
ANILINE
- Écrit par Alain TRINQUIER
- 1 376 mots
- 2 médias
D'abord extraite des goudrons de houille (Runge, 1834), l'aniline se prépare actuellement à partir du benzène par l'intermédiaire soit du chlorobenzène, soit du nitrobenzène. -
AROMATICITÉ
- Écrit par André JULG
- 4 707 mots
- 2 médias
C'est cet état conjugué qui est à l'origine du caractère aromatique. Considérons en effet la molécule debenzène. D'après le schéma classique de Kekulé (formule 1), cette molécule devrait posséder trois doubles liaisons. Mais par analogie avec ce que nous avons vu dans le butadiène, les électrons... -
ARYLES RADICAUX
- Écrit par Dina SURDIN
- 34 mots
-
ASTROCHIMIE
- Écrit par David FOSSÉ et Maryvonne GERIN
- 4 390 mots
- 3 médias
...en de formidables réacteurs chimiques où l'on observe PAH et petits hydrocarbures. C'est là, pense-t-on, que les poussières carbonées sont synthétisées. Et c'est aussi dans l'atmosphère d'une de ces usines à suies, baptisée CRL 618, qu'a été découverte en 2001 la molécule de ... - Afficher les 19 références
Voir aussi