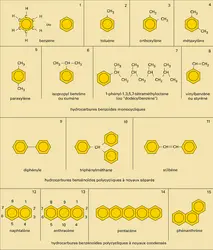
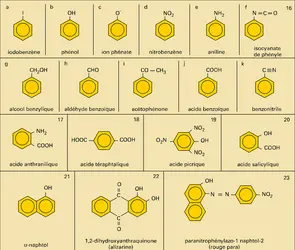
BENZÉNOÏDES
Propriétés physiques
Les domaines dans lesquels les composés aromatiques présentent des propriétés physiques spécifiques sont les suivants :
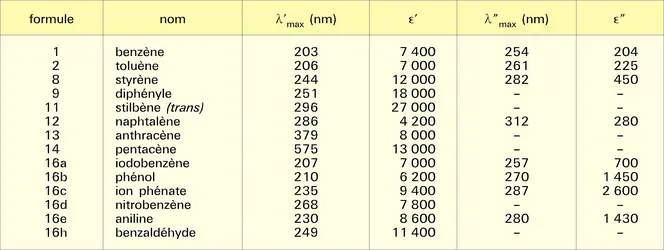
Absorption ultraviolette
En raison de sa conjugaison cyclique, le système électronique π de ces composés est plus facile à déformer que celui des doubles liaisons isolées et même des systèmes ouverts. L'absorption propre du système aromatique se situe dans le proche ultraviolet et l'extension de la conjugaison par introduction, dans le système, de substituants appropriés, comme le groupe nitro- (, formule 16 d) ou azoïque(, formule 23), provoque le déplacement (bathochrome) de l'absorption dans le spectre visible. On dit, pour cette raison, que les squelettes benzénoïdes sont des chromophores et que les substituants fonctionnels conjugués sont des auxochromes. La structure fine de la bande d'absorption, de plus grande longueur d'onde et de faible intensité, appelée bande benzénoïde (, λ″) est assez complexe et caractéristique des structures aromatiques (structure vibrationnelle).
Absorption infrarouge
La nature particulière des liaisons des squelettes benzénoïdes entraîne pour ces derniers l'apparition dans leur spectre d'absorption infrarouge (et de diffusion Raman) de bandes caractéristiques qui permettent leur identification. On note en particulier deux bandes dans le domaine 1 500-1 600 cm-1 dues à des vibrations d'élongation ν C-C et la bande située vers 3 030 cm-1 due aux vibrations d'élongation ν C-H du cycle.
Absorption en résonance magnétique nucléaire
Les atomes d'hydrogène portés par les cycles aromatiques résonnent aux champs faibles en comparaison de ceux que portent les systèmes conjugués ouverts. La cause principale de cette différence réside dans l'existence, pour les systèmes benzénoïdes, d'un courant de cycle qui crée, au niveau des protons de ces systèmes, un petit champ qui s'ajoute au champ extérieur et augmente ainsi le champ local. Ce déblindage propre aux systèmes aromatiques est utilisé en analyse structurale pour identifier les « protons aromatiques ». L'analyse des couplages de spin JH-H permet également de distinguer entre isomères de positions : JH-Hortho- = 5 à 8 Hz ; JH-Hméta- = 1 à 3 Hz ; JH-Hpara- = 0 à 1 Hz.
Le couplage de spin nucléaire entre un proton et l'isotope 13C du carbone aromatique auquel il est lié (la concentration dans la nature de 13C qui est de 1 p. 100 permet parfois de l'observer sans enrichissement) présente une valeur caractéristique de ces systèmes (J 13CH = 159 Hz pour le benzène).
Spectrométrie de masse
L'importante stabilisation due à la conjugaison cyclique du système électronique π des molécules benzénoïdes entraîne une difficulté relative des processus de fragmentation de leurs cycles. La conjugaison propre aux cations du type du benzylium, C6H5 − CH2+, confère à ces fragments une stabilité particulière qui les fait régulièrement apparaître dans le spectre de masse des composés de structure C6H5 − CH2 − R, à la position m/e = 91, sous la forme particulièrement stable d'ions tropylium. D'une manière générale, le spectre d'un composé benzénoïde, dont la formule est R′ − C6H4 − CH2 − R, contient le fragment cationique R′ − C7H6+.
Les structures polycycliques, à cycles indépendants ou condensés, présentent également une faible fragmentation au niveau de leurs cycles.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Médias
Autres références
-
ANTHRACÈNE
- Écrit par Dina SURDIN
- 233 mots
Formule brute : C14H10
Masse moléculaire : 178,22 g
Masse spécifique : 1,25 g/cm3
Point de fusion : 217 0C
Point d'ébullition : 354-355 0C.
Cet hydrocarbure cyclique cristallise en prismes monocliniques incolores et présente une fluorescence violette quand il est absolument pur.
L'énergie...
-
AROMATICITÉ
- Écrit par André JULG
- 4 707 mots
- 2 médias
Considérons d'abord les hydrocarbures. Deux cas se présentent :ou bien la molécule ne contient que des cycles pairs (hydrocarbures benzénoïdes), ou bien elle possède au moins un cycle impair (fulvène, azulène et molécules dérivées : benzofulvène, benzoazulène...). Dans les premières molécules,... -
ASTROCHIMIE
- Écrit par David FOSSÉ et Maryvonne GERIN
- 4 390 mots
- 3 médias
...de carbone, et l'on pense qu'ensemble elles recèlent de 10 à 20 p. 100 du carbone cosmique. Pourtant, aucune n'a jamais été spécifiquement identifiée. C'est pour expliquer la présence de bandes caractéristiques dans le spectre infrarouge de nombreuses nébuleuses que les astronomes ont en effet imaginé... -
BENZÈNE
- Écrit par Dina SURDIN
- 478 mots
Le plus simple des hydrocarbures aromatiques.
Formule : C6H6

Fréquemment symbolisé par :

Masse moléculaire : 78,11 g
Masse spécifique : 0,88 g/cm3
Point de fusion : 5,5 0C
Point d'ébullition : 80,09 0C.
Cristaux incolores dans le système orthorhombique bipyramidal. Forme un azéotrope...
- Afficher les 11 références