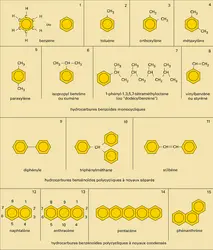
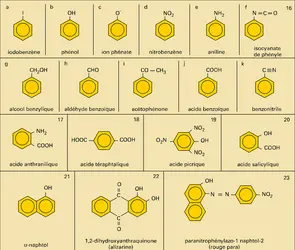
BENZÉNOÏDES
Préparations. Utilisations
Jusqu'au milieu du siècle environ, les hydrocarbures aromatiques industriels étaient obtenus comme sous-produits de la pyrogénation des charbons (1 000-1 300 0C) en vue de la fabrication du coke métallurgique ou du gaz d'éclairage (benzène, toluène, xylènes, naphtalène, méthyl-naphtalènes, anthracène...). Progressivement les pétroles remplacent le charbon comme source de ces carbures : les procédés d'aromatisation et de déhydrocyclisation des hydrocarbures alicycliques et aliphatiques permettent en effet de produire à bon compte le toluène, les xylènes et le benzène.
La préparation au laboratoire d'hydrocarbures aromatiques fait appel soit à l'alkylation de Friedel et Crafts de substrats benzénoïdes, soit à l'acylation suivie de réduction et de déshydrogénation (cyclisation notamment) ; elle peut également se faire par l'intermédiaire de dérivés organo-métalliques aromatiques.
Les hydrocarbures benzénoïdes et leurs dérivés fonctionnels ont une importance économique considérable ; par leur stabilité, ils interviennent dans la fabrication de fluides de transfert thermique, de matériaux thermostables, d'élastomères résistants ; par la rigidité de leur squelette, ils sont utilisés dans la confection de fibres textiles synthétiques, de mousses plastiques rigides, de résines thermodurcissables fines ; par la facilité avec laquelle ils subissent des réactions de substitution, ils représentent des matières premières de choix pour l'introduction de groupements fonctionnels et interviennent dans la synthèse de médicaments, de pesticides, de solvants, de détergents ; par leur caractère chromophore, ils sont à la base de l'industrie des matières colorantes de synthèse.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Médias
Autres références
-
ANTHRACÈNE
- Écrit par Dina SURDIN
- 233 mots
Formule brute : C14H10
Masse moléculaire : 178,22 g
Masse spécifique : 1,25 g/cm3
Point de fusion : 217 0C
Point d'ébullition : 354-355 0C.
Cet hydrocarbure cyclique cristallise en prismes monocliniques incolores et présente une fluorescence violette quand il est absolument pur.
L'énergie...
-
AROMATICITÉ
- Écrit par André JULG
- 4 707 mots
- 2 médias
Considérons d'abord les hydrocarbures. Deux cas se présentent :ou bien la molécule ne contient que des cycles pairs (hydrocarbures benzénoïdes), ou bien elle possède au moins un cycle impair (fulvène, azulène et molécules dérivées : benzofulvène, benzoazulène...). Dans les premières molécules,... -
ASTROCHIMIE
- Écrit par David FOSSÉ et Maryvonne GERIN
- 4 390 mots
- 3 médias
...de carbone, et l'on pense qu'ensemble elles recèlent de 10 à 20 p. 100 du carbone cosmique. Pourtant, aucune n'a jamais été spécifiquement identifiée. C'est pour expliquer la présence de bandes caractéristiques dans le spectre infrarouge de nombreuses nébuleuses que les astronomes ont en effet imaginé... -
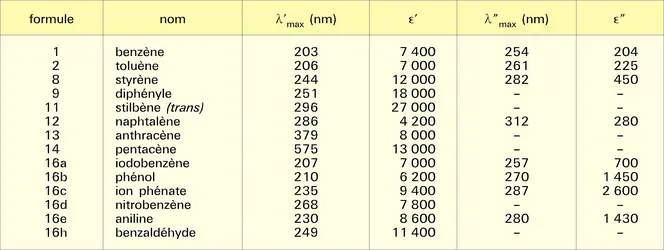
BENZÈNE
- Écrit par Dina SURDIN
- 478 mots
Le plus simple des hydrocarbures aromatiques.
Formule : C6H6

Fréquemment symbolisé par :

Masse moléculaire : 78,11 g
Masse spécifique : 0,88 g/cm3
Point de fusion : 5,5 0C
Point d'ébullition : 80,09 0C.
Cristaux incolores dans le système orthorhombique bipyramidal. Forme un azéotrope...
- Afficher les 11 références