BORE
Le bore est l'élément chimique de symbole B et de numéro atomique Z = 5. Bien que sa chimie soit mal connue et en pleine évolution, les emplois de ses dérivés sont anciens, nombreux et importants.
Au début du Moyen Âge, on importait en Europe du borax, venu des Indes, sous des noms (d'origine arabe ?) tels que « tincar », « tinckal »... Vers 1500, ce produit est appelé (origine perse) « baurach », « bauraq »... Extrait du borax en 1702 par Homberg et d'abord nommé « sel sédatif », « sel volatil narcotique de vitriol », « acide du borax », « acide boracin », « acide boracique », l'acide borique a été ainsi appelé, vers 1810, par Gay-Lussac et Thénard. Le mot bore est dû aux mêmes auteurs qui, en même temps que Davy, et de façon indépendante, ont préparé pour la première fois, en 1808, du bore élémentaire très impur. Les alchimistes se servaient déjà du borax comme flux dans la fusion et la soudure des métaux. Encore aujourd'hui, le borax et l'acide borique entrent dans la composition des flux utilisés en métallurgie ; ils servent à l'ignifugation du bois et des tissus ; on les trouve dans la composition des émaux utilisés en céramique et dans la composition de verres du type Pyrex ; on les emploie en galvanoplastie, photographie, tannerie, papeterie, blanchisserie, teinturerie et pour la fabrication des colles, des condensateurs électrolytiques... L'acide borique, qui figure comme antiseptique dans la pharmacopée, est toxique ; il ne doit pas être employé pour la conservation des aliments. De son côté, la borocalcite est utilisée comme fertilisant (betterave, pommier...). Les perborates servent au blanchiment des textiles. Le fluorure de bore est un catalyseur énergique, analogue au chlorure d'aluminium, utilisé en chimie organique. Les hydrures, proposés comme carburants pour fusées, servent au « dopage » des semi-conducteurs, et les borohydrures (qui permettent d'obtenir facilement les hydrures) sont des réducteurs sélectifs utilisés en chimie organique. Il faut encore citer le nitrure de bore utilisé comme réfractaire, le carbure de bore et les borures des métaux de transition employés comme réfractaires ou comme abrasifs, le borure de fer permettant de désoxyder l'acier et d'en améliorer les propriétés mécaniques. Ces corps servent aussi dans l'industrie nucléaire pour absorber les neutrons lents (10B ayant une section efficace de capture cinq fois plus grande que celle du 11B) ; ils semblent devoir servir à renforcer les matières plastiques plus efficacement que les fibres de verre. L'emploi du bore élémentaire a été préconisé en particulier pour améliorer les caractéristiques des combustibles pour fusées.
Le bore a pour masse atomique 10,82. Il possède deux isotopes naturels, 10B (18,8 p. 100) et 11B (81,2 p. 100) ; on sait, de plus, obtenir deux isotopes radioactifs de périodes courtes, 8B et 12B, par bombardement de 9Be, 10B, 11B, 12C et 15N.
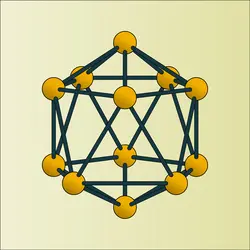
Sa structure électronique est 1s2, 2s2, 2p1 ; il appartient de ce fait au groupe III b de la classification périodique (B, Al, Ga, In, Tl). D'après cette structure, seul l'électron 2p n'étant pas apparié, le bore devrait être monovalent ; en fait il suffit de fournir une énergie d'activation très faible (167 joules par atome-gramme) pour que, l'un des électrons 2s passant sur l'orbitale 2p, le bore soit toujours trivalent. La différence d'énergie entre les niveaux 2s et 2p est trop faible pour qu'il puisse être bivalent ; ceci cadre du reste avec le fait que le bore lui-même et ses dérivés sont diamagnétiques et avec le fait que dans des corps tels que (BX2)2, (B(OH)2)2 ou (BO)2 on trouve des structures fragiles du type > B–B <, et, dans (BX)n, des structures spatiales dans lesquelles le bore est trivalent.
Suivant[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean CUEILLERON : professeur à la faculté des sciences de Lyon
Classification
Médias
Autres références
-
ACIER - Technologie
- Écrit par Louis COLOMBIER , Gérard FESSIER , Guy HENRY et Joëlle PONTET
- 14 178 mots
- 10 médias
Le bore, ajouté à l'acier en quantité extrêmement faible, accroît la trempabilité et, dans des aciers très spéciaux, améliore la résistance mécanique et la ductilité aux températures élevées. -
BOROPHÈNE
- Écrit par Bernard PIRE
- 991 mots
- 1 média
-
HYDROGÈNE
- Écrit par Paul HAGENMULLER
- 3 540 mots
- 6 médias
-
IONS ÉCHANGEURS D'
- Écrit par Robert ROSSET
- 6 110 mots
- 13 médias
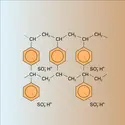
Avec une résine telle que le N-méthyl-glucaminium, la fixation dubore est une réaction pratiquement spécifique mettant en jeu deux chaînes glucidiques pour un ion borate B(OH)-4 avec formation du complexe représenté par la formule de la figure. On peut ainsi récupérer le bore dans des milieux très... - Afficher les 12 références