BORE
Article modifié le
Dérivés oxygénés
Il existe une série de sous-oxydes, difficiles à préparer, par exemple en oxydant le bore à température très élevée, et dont les formules seraient comprises entre B2O3 et B7O ; on peut admettre l'existence en particulier de (BO)n et d'un oxyde de formule controversée B6O, B7O ou B13O2.
Les structures de ces corps sont mal connues et certains donnent par action de l'eau des acides réducteurs (acides hypoboriques), par exemple : H4B2O4 ; H3BO2 ; H2B4O6 ; H4B2O2 ; H2B2O2..., acides dont on connaît des sels et des esters.
L' anhydride borique B2O3 est l'oxyde normal qu'on obtient par déshydratation de l'acide borique. Il se présente soit à l'état cristallisé (réseau hexagonal), forme difficilement obtenue par un long recuit à 250 0C, soit à l'état vitreux. La forme vitreuse, très dure, est constituée par l'assemblage de polygones B4O6, dans lesquels les liaisons B−O sont très lâches. À l'état liquide l'anhydride borique est associé ; ceci permet d'en expliquer les propriétés physiques (bas point de « fusion », viscosité élevée...).
L'anhydride borique fondu dissout pratiquement tous les oxydes métalliques ; par refroidissement de telles solutions, on obtient, soit un verre homogène, soit un dépôt d'oxydes ou de borates. Il est possible, comme dans l'eau, d'obtenir, dans l'anhydride borique fondu, des réactions de double décomposition entre deux sels dissous ou, par électrolyse, un dépôt de bore, de métal ou de borures.
En fonction de sa chaleur de formation élevée (300 kcal/mole) l'anhydride borique n'est réduit que par des réducteurs puissants (alcalins, Mg, Ca...), avec libération de bore et formation de borures.
Acides boriques
Par hydratation, l'anhydride borique donne successivement l'acide métaborique HBO2 (monohydrate de B2O3), puis l'acide orthoborique H3BO3 (trihydrate de B2O3), mais ne semble pas donner l'acide pyroborique H2B4O7 dont l'existence prête à discussion.
L'acide métaborique (ou monoborique) HBO2 existe sous trois formes cristallines ; la variété courante, orthorhombique, est constituée par des groupes BO3 liés entre eux par liaison hydrogène et disposés en couches parallèles. Il semble exister en solution sous forme dimère :

L' acide orthoborique (ou borique) H3BO3 cristallise en paillettes tricliniques incolores ou blanches, onctueuses, qui se disposent en couches parallèles, liées par des liaisons de Van der Waals assez faibles.
La solubilité de l'acide orthoborique dans l'eau est sept fois plus grande à 100 0C qu'à la température ambiante (50 g/l), ce qui permet sa purification. Il est entraîné par la vapeur d'eau, bien avant l'ébullition, peut-être à l'état d'acide métaborique.
En solution l'acide orthoborique est un monoacide très faible qui se dissocie légèrement suivant :

Avec les composés minéraux, l'acide borique donne des borates ; avec les alcools, il donne des esters B(OR)3 très hydrolysables, lesquels, par action des halogénures de bore, se transforment en esters halogénoboriques BX(OR)2 et BX2OR.
Avec les corps polyhydroxylés (glycérine, acides-alcools, acides-phénols...) l'acide borique donne de nombreux complexes. En particulier, la glycérine et surtout le mannitol conduisent à la formation de complexes d'addition qui sont des acides beaucoup plus forts que l'acide borique pur ; avec cet acide très faible, on n'observe pas, lors du dosage par la soude, de[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean CUEILLERON : professeur à la faculté des sciences de Lyon
Classification
Médias
Autres références
-
ACIER - Technologie
- Écrit par Louis COLOMBIER , Gérard FESSIER , Guy HENRY et Joëlle PONTET
- 14 178 mots
- 10 médias
Le bore, ajouté à l'acier en quantité extrêmement faible, accroît la trempabilité et, dans des aciers très spéciaux, améliore la résistance mécanique et la ductilité aux températures élevées. -
BOROPHÈNE
- Écrit par Bernard PIRE
- 991 mots
- 1 média
-
HYDROGÈNE
- Écrit par Paul HAGENMULLER
- 3 540 mots
- 6 médias
-
IONS ÉCHANGEURS D'
- Écrit par Robert ROSSET
- 6 110 mots
- 13 médias
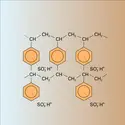
Avec une résine telle que le N-méthyl-glucaminium, la fixation dubore est une réaction pratiquement spécifique mettant en jeu deux chaînes glucidiques pour un ion borate B(OH)-4 avec formation du complexe représenté par la formule de la figure. On peut ainsi récupérer le bore dans des milieux très... - Afficher les 12 références
Voir aussi