BORE
Carbure de bore
La formule B12C3 est encore discutée à cause des difficultés de dosage des deux éléments (libres ou combinés) et elle est rendue incertaine par la formation de solutions solides de substitution (remplacement, dans la maille, d'atomes de carbone par du bore).
Il est obtenu à température élevée soit par synthèse directe, soit en faisant réagir du carbone sur de l'anhydride borique ou en chauffant du bore dans un mélange d'oxyde de carbone et d'hydrogène.
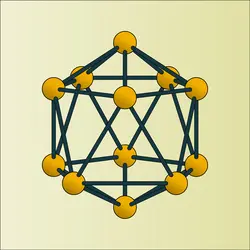
En raison de sa structure icosaédrique, le carbure est plus dur que le diamant, il est relativement peu fragile et son point de fusion est élevé (2 350 0C). Il est extrêmement réducteur. On l'emploie comme abrasif (analogue au carbure de tungstène), comme réfractaire, comme désoxydant en métallurgie et, en physique nucléaire, comme matériau absorbant les neutrons lents.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean CUEILLERON : professeur à la faculté des sciences de Lyon
Classification
Médias
Autres références
-
ACIER - Technologie
- Écrit par Louis COLOMBIER , Gérard FESSIER , Guy HENRY et Joëlle PONTET
- 14 178 mots
- 10 médias
Le bore, ajouté à l'acier en quantité extrêmement faible, accroît la trempabilité et, dans des aciers très spéciaux, améliore la résistance mécanique et la ductilité aux températures élevées. -
BOROPHÈNE
- Écrit par Bernard PIRE
- 991 mots
- 1 média
-
HYDROGÈNE
- Écrit par Paul HAGENMULLER
- 3 540 mots
- 6 médias
-
IONS ÉCHANGEURS D'
- Écrit par Robert ROSSET
- 6 110 mots
- 13 médias
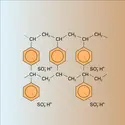
Avec une résine telle que le N-méthyl-glucaminium, la fixation dubore est une réaction pratiquement spécifique mettant en jeu deux chaînes glucidiques pour un ion borate B(OH)-4 avec formation du complexe représenté par la formule de la figure. On peut ainsi récupérer le bore dans des milieux très... - Afficher les 12 références