BROME
Article modifié le
Du grec brômos, puanteur
Symbole chimique : Br
Numéro atomique : 35
Masse atomique : 79,904 g
Point de fusion : — 7,2 0C
Densité (à 20 0C) : 3,12.
Liquide rouge sombre d'odeur piquante, irrite la peau, les yeux et les voies respiratoires ; l'inhalation à l'état de vapeur est très dangereuse, voire mortelle. Ses solutions dans l'eau (eau de brome) laissent déposer par refroidissement un hydrate rouge. Il est peu répandu dans la nature, et ses composés accompagnent ceux du chlore dans un rapport d'environ 1/250 dans l'eau de mer et certaines sources thermales, ainsi que dans quelques minerais insolubles de bromure d'argent.
Le brome a été découvert par Antoine Jérôme Balard dans les eaux de la Méditerranée (1826), et on le prépare habituellement à partir des eaux mères des salines comme sous-produit, après la cristallisation des principaux sels qui y sont contenus ; un courant de chlore déplace le brome qui se trouve sous forme de bromure de magnésium et que l'on sépare par distillation. On le prépare aussi par électrolyse de la carnallite ou de la sylvinite bromée.
Le brome est un oxydant puissant donnant lieu à des réactions violentes avec le phosphore, les métaux alcalins, l'aluminium, etc. Il attaque de nombreux métaux, surtout en présence d'humidité, en donnant des bromures (ion Br—). Comme le chlore, il forme des hypobromites (BrO—), des bromites (BrO2) et des bromates (BrO3). Avec les autres halogènes, il donne de nombreux bromures (mono-, tri- et penta-), surtout avec le fluor.
Le brome est utilisé principalement pour la fabrication du dibromure d'éthylène, servant d'antichoc dans les essences dopées au plomb et comme stérilisateur du sol.
Le bromure de méthyle est employé comme agent fumigène et dans la synthèse de quelques matières colorantes (bromo-indigos). L'élément est un réactif habituel dans les laboratoires et il est aussi utilisé pour les synthèses organiques.
Les bromures alcalins et alcalinoterreux et de nombreux bromures organiques sont employés comme sédatifs ; plus particulièrement, le bromure d'argent constitue le composant principal des émulsions photographiques.
On connaît de nombreux isotopes stables et radioactifs du brome, parmi lesquels l'isotope radioactif de nombre atomique 80 présente le phénomène d'isomérie nucléaire, dû à deux états d'excitations différents.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Bertrand DREYFUS
: licencié ès sciences,
bachelor of sciences , University of Chicago
Classification
Autres références
-
BALARD ANTOINE JÉRÔME (1802-1876)
- Écrit par Georges BRAM
- 471 mots
Chimiste français né le 30 septembre 1802 à Montpellier et mort le 30 avril 1876 à Paris. Issu d'une modeste famille de vignerons, Balard fait ses études supérieures à l'université de sa ville natale. Il y suit les enseignements de pharmacie – il obtient son doctorat en 1826 – et parallèlement ceux...
-
BROMURE D'HYDROGÈNE
- Écrit par Encyclopædia Universalis
- 309 mots
Formule brute : HBr
Masse moléculaire : 80,92 g
Point de fusion : — 88,5 0C
Point d'ébullition : — 67 0C
Température critique : 89,9 0C
Gaz de forte odeur piquante formant dans l'air un nuage lourd ; âcre et corrosif, il irrite fortement la peau et les muqueuses. Par abaissement...
-
ÉCLAIRAGE DOMESTIQUE
- Écrit par Georges ZISSIS
- 8 154 mots
- 12 médias
...pour protéger le filament, la lampe halogène renferme également un gaz halogéné – qui se présente dans ce cas sous la forme d’un composant organique du brome, élément chimique de la famille des halogènes. Ce gaz permet d’augmenter la température du filament de tungstène (donc le rendement de la lampe)... -
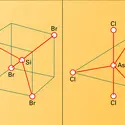
HALOGÈNES
- Écrit par Jacques METZGER et Robert de PAPE
- 6 602 mots
- 5 médias
Les dérivés halogénés résultent du remplacement, par des halogènes F, Cl,Br, I, d'un ou de plusieurs atomes d'hydrogène des hydrocarbures. Ils se rencontrent rarement à l'état naturel : présence d'iode dans la tyroxine, présence de chlore dans l'antibiotique chloromycétine.... - Afficher les 7 références
Voir aussi