CALCIUM
Article modifié le
Chaux vive ; chaux éteinte
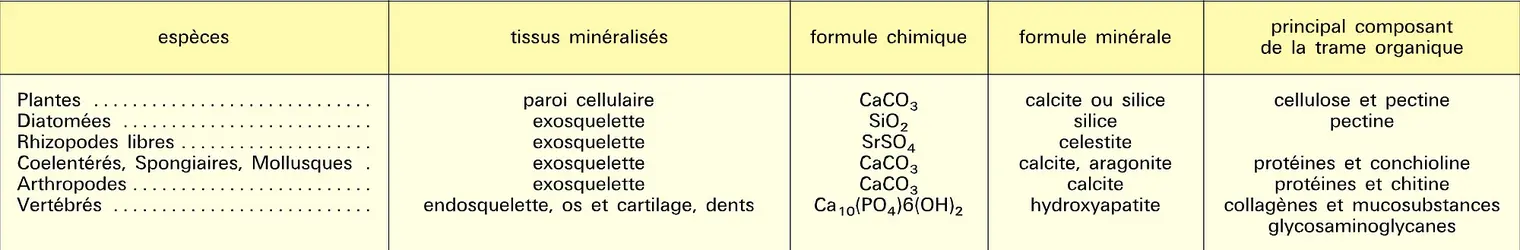
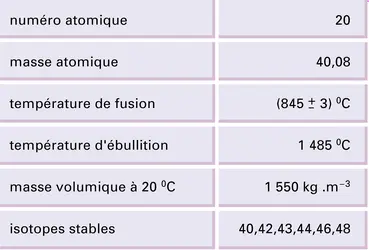
Par calcination du nitrate, du carbonate ou d'un sel organique, ou par oxydation du métal, se forme l'oxyde, ou chaux vive. La chaleur de formation à partir des éléments s'élève à − 636 kJ/mol : cette valeur est une des plus élevées parmi celles de tous les oxydes connus ; aussi la chaux sera-t-elle un composé très difficile à réduire ; elle ne fond qu'à 2 575 0C, ce qui permet de l'utiliser comme revêtement réfractaire. Chauffée en flamme oxydante, elle émet une lumière très blanche autrefois utilisée pour éclairer les scènes de théâtre (lime light, lumière de la chaux). Comme tous les oxydes alcalino-terreux, la chaux cristallise dans un système du type chlorure de sodium, mais, contrairement à eux, elle n'absorbe pas d'oxygène pour constituer un peroxyde. La chaux absorbe facilement et réversiblement l'eau et le gaz carbonique tant qu'elle n'a pas été trop calcinée ; ces deux réactions sont à la base de la prise des mortiers constitués de chaux, de sable et d'eau ; la chaux s'hydrate, puis se carbonate, à l'air, l'ensemble donnant une masse dure dont le volume s'accroît lors de la prise, contribuant ainsi à la solidité des scellements.
La chaux éteinte est une bibase forte qui déplace l'ammoniac de ses sels. Par chauffage, elle se déshydrate au-delà de 300 0C. On utilise des solutions saturées de chaux ou eau de chaux, au laboratoire, pour caractériser l'anhydride carbonique qui provoque un précipité de carbonate ; un excès de gaz carbonique redissout le précipité, le calcium passant à l'état d'hydrogénocarbonate soluble. Ce phénomène intervient de façon déterminante dans la dissolution des roches calcaires par les eaux chargées en dioxyde de carbone.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean PERROTEY : docteur ès sciences, maître assistant à l'université de Haute-Normandie
Classification
Médias
Autres références
-
ACIDIFICATION DES OCÉANS
- Écrit par Paul TRÉGUER
- 2 202 mots
- 5 médias
...actuel, avec un pH de 8,1, la concentration en bicarbonates domine largement celle des carbonates et celle du CO2 libre dissous. Dans ces conditions, les ions calcium (Ca2+) de l'eau de mer réagissent avec les bicarbonates pour former du carbonate de calcium (CaCO3) ou calcaire. Ce composé peut précipiter... -
ALIMENTATION (Aliments) - Classification et typologie
- Écrit par Ambroise MARTIN
- 4 590 mots
- 1 média
...dérivent) est le plus largement utilisé. Tous les laits sont des sources de protéines animales de bonne qualité, de différentes vitamines et de minéraux. Aujourd'hui, ils sont essentiellement valorisés pour leur teneur en calcium, élément dont l'intérêt est largement démontré pour la santé de l'... -
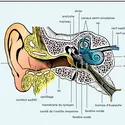
AUDITION - Acoustique physiologique
- Écrit par Pierre BONFILS , Yves GALIFRET et Didier LAVERGNE
- 14 814 mots
- 17 médias
...de liaison avec la calmoduline nécessaire à la régulation du système par le calcium. Lorsque la tension du ressort ouvre les canaux de transduction, le Ca++ entre avec le K+ et l'accumulation de Ca++ bloque le mécanisme ascensionnel de la myosine qui glisse vers la base, sollicitée par l'excès de... -
CHONDROCALCINOSE
- Écrit par Encyclopædia Universalis
- 402 mots
Maladie « métabolique » caractérisée, au niveau des cartilages articulaires, par des calcifications (dépôt de microcristaux de pyrophosphate de calcium) visibles sur des radiographies, à partir de la cinquantaine, car cette affection augmente de fréquence avec l'âge de telle sorte que 25 p. 100...
- Afficher les 22 références
Voir aussi