CARBONE
Article modifié le
Composés
Composés d'insertion
La structure très particulière du graphite (couches planes faiblement liées les unes aux autres) rend possible l'insertion d'atomes étrangers entre ces couches.
La structure rigide des carbones non graphitables rend difficile l'écartement des plans d'hexagones d'atomes ; dans les carbones graphitables, il existe une possibilité d'insertion d'atomes entre ces plans ; mais ceux-ci sont peu étendus et ainsi l'influence des bords de feuillets y est plus importante que dans le graphite, ce qui conduit à des composés d'insertion de compositions variées. On se rapproche d'autant plus des valeurs d'insertion obtenues avec le graphite que le carbone graphitable a été chauffé à température plus élevée et se trouve plus graphité.
Des composés d'insertion ont été obtenus avec le potassium, le césium, le fluor, le brome, des chlorures (parmi lesquels le chlorure ferrique a donné un produit très étudié), des oxydes, des sulfures, des acides concentrés (sulfurique, nitrique). Avec le fluor, par exemple, on obtient des produits de formules CF ou C4F ; avec le potassium C24K et C8K entre autres. Des produits d'oxydation particuliers du type insertion ont été obtenus avec des mélanges oxydants tels que le chlorate de potassium en présence d'acide nitrique. Ces produits ont été appelés acides ou oxydes graphitiques.
Halogénures
Plusieurs composés binaires de fluor et de carbone sont connus : CF4, C2F6, C3F8... Ils sont gazeux à la température ordinaire et se forment surtout par chauffage au rouge du composé d'insertion CF. La composition de ce dernier peut varier entre CF0,68 et CF0,99 et il est obtenu par action du fluor sur le graphite à 420-450 0C sous la pression atmosphérique, les atomes de fluor formant une couche de part et d'autre de chaque couche de carbone. Il existe un autre composé d'insertion, le composé solide C4F dont la formule peut varier entre C4F et C3,6F et qui est obtenu par passage d'un mélange de fluor et d'acide fluorhydrique sur le graphite à la température ordinaire.
Le tétrachlorure de carbone CCl4 ne peut se préparer par action directe du chlore sur le carbone. Ce corps est l'objet d'une fabrication industrielle et peut être obtenu par la réaction :

L' oxychlorure de carbone COCl2, appelé encore phosgène, se forme par addition du chlore sur l'oxyde de carbone. C'est un gaz incolore, suffocant, extrêmement toxique, qui fut utilisé comme gaz de combat pendant la Première Guerre mondiale. Chlorure d'acide de l'acide carbonique, l'eau le décompose assez rapidement en libérant l'anhydride :

C'est un intermédiaire des industries des colorants et des produits pharmaceutiques.
Le tétrabromure et le tétraiodure de carbone sont solides à la température ordinaire et on connaît différents autres dérivés oxyhalogénés du carbone tels que l'oxyfluorure COF2 gazeux à la température ordinaire et l'oxybromure COBr2 liquide très toxique.
Oxydes
Trois composés binaires du carbone et de l'oxygène, de formules respectives C3O2, CO et CO2 sont connus. Seuls les deux derniers sont importants.
Le sous-oxyde C3O2 est un liquide toxique. Il est obtenu soit par décomposition thermique sous pression réduite de l'anhydride diacétyltartrique ou de l'acide malonique en présence d'anhydride phosphorique. Peu stable, il se polymérise en un solide rouge. Il se comporte aussi comme un anhydride de l'acide malonique.
Monoxyde
Ce composé est préparé en quantités considérables dans l'industrie, généralement en mélange avec d'autres gaz, tout particulièrement par combustion incomplète du carbone (gaz à l'air) et par action de la vapeur d'eau sur le carbone au rouge selon la réaction :

Le gaz de cokerie produit par pyrolyse de la houille renferme une certaine quantité d'oxyde de carbone. C'est un gaz incolore et inodore. Très peu soluble dans l'eau, il est absorbé par une solution chlorhydrique de chlorure cuivreux. Il se forme un composé d'addition qui peut cristalliser en cristaux blancs.
Les points d'ébullition (− 190 0C) et de fusion (− 205,1 0C), ainsi que la densité gazeuse, sont très voisins des valeurs correspondantes relatives à l'azote dont la molécule a le même nombre d'électrons : 14.
Stable aux températures élevées, l'oxyde de carbone se décompose au-dessous de 1 000 0C suivant la réaction :

À la température ordinaire, l'oxyde de carbone subsiste indéfiniment à l'état métastable. La réaction de décomposition précédente est encore appelée réaction de Boudouart ; elle correspond, sous une atmosphère et à 25 0C, à une variation d'enthalpie de − 39 kcal par mole de CO. La décomposition est catalysée par de nombreux métaux et oxydes (en particulier le fer et ses oxydes). À 400 0C l'oxyde de carbone est à peu près complètement dissocié à l'équilibre ; les caractéristiques de l'équilibre sont données dans le tableau.
L'oxyde de carbone est réduit par l'hydrogène et la réaction évolue de façon très différente suivant les substances en présence desquelles se trouve mis le mélange d'oxyde de carbone et d'hydrogène.
En présence de fer on peut observer une carburation :

En présence de corps jouant le rôle de catalyseur, on observe des effets parfois très sélectifs. La réaction la plus simple conduit au méthane et a été découverte en 1902 par Sabatier et Senderens qui opéraient à 230-250 0C sous la pression atmosphérique et en présence de nickel :

On a découvert que d'autres catalyseurs permettaient d'obtenir des mélanges d'hydrocarbures : la pression utilisée peut atteindre dans certains cas plusieurs centaines d'atmosphères. De telles réactions ont eu certaines applications industrielles : synthèse de combustibles liquides surtout en Allemagne durant la dernière guerre mondiale.
Le terme final dépend du catalyseur. Les catalyseurs au fer donnent une proportion élevée d'alcènes.
Mais la réaction, dans des conditions convenables, donne des produits oxygénés (alcools, glycols, cétones, etc.).
De ces dernières réactions, la plus importante actuellement est la synthèse industrielle du méthanol qui utilise des pressions de quelques centaines d'atmosphères. Le produit obtenu est d'une pureté supérieure à 99 p. 100.
La réaction CO + 2H2 → CH3OH est catalysée par de nombreuses substances dont les principales sont les oxydes de zinc et de chrome et le cuivre, les deux oxydes utilisés seuls ou en mélange, avec ou sans adjonction de promoteur, par exemple le système formé de 11 p. 100 en poids de Cr2O3 et de 89 p. 100 de ZnO a fourni à 375 0C un méthanol très pur.
L'oxyde de carbone est un composé non saturé susceptible de réactions d' addition. Avec l'oxygène, la réaction est exothermique et l'oxyde de carbone est un combustible :
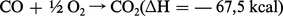
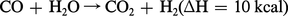
De nombreuses réactions d'addition autres que la seule combustion ont été observées : addition d'halogènes, de soufre, de cyanogène, de soude.
L'addition avec les oléfines est très importante, c'est la réaction « oxo » qui permet la synthèse industrielle de nombreux dérivés organiques et en particulier d'alcools utilisés comme plastifiants.
L' oxyde de carbone s'additionne aussi à l'hémoglobine du sang en provoquant une anoxie. Cette intoxication est extrêmement fréquente ; sa forme aiguë constitue l'une des formes les plus courantes de suicide. Elle débute par des maux de tête, une baisse de l'acuité auditive et souvent une impression angoissante de manque d'air. Le coma survient au bout d'un temps variable qui est fonction de la teneur de l'atmosphère en oxyde de carbone. Convenablement traité (respiration artificielle d'oxygène pur), il évolue vers la guérison. Les complications, essentiellement neuro-psychiatriques, sont rares mais très graves. Non traité, le coma évolue vers la mort. Le cadavre présente une couleur rosée ou rouge caractéristique. Le diagnostic doit être confirmé par une étude spectroscopique du sang.
L'oxyde de carbone donne des composés d'addition très intéressants avec des métaux tels que le nickel, le fer et d'autres métaux de transition des 6e, 7e et 8e groupes. Ces composés sont appelés métaux carbonyles.
Carbonyles métalliques
Dans ces composés, l'oxyde de carbone se trouve directement lié au métal par l'atome de carbone ; la liaison est une liaison simple de covalence dative ou bien, lorsqu'il y a plusieurs noyaux métalliques, le radical carbonyle bivalent forme parfois un pont entre deux atomes métalliques voisins. La dénomination « carbonyle » reste donc critiquable mais elle est consacrée par l'usage. D'autre part, cette définition exclut, à juste titre, les combinaisons obtenues en fixant l'oxyde de carbone sur les métaux alcalins et alcalino-terreux qui sont des produits de substitution par ces métaux d'hydrogènes appartenant à des molécules organiques.
C'est en 1888 que fut découvert par Mond, Langer et Quincke le premier carbonyle métallique, celui de nickel, Ni(CO)4, utilisé pour purifier industriellement ce métal par élimination du cobalt. Par la suite, l'emploi d'oxyde de carbone sous fortes pressions permit à Mond et à ses collaborateurs d'isoler d'autres carbonyles, de 1891 à 1910. Une autre méthode de préparation faisant appel aux organomagnésiens de Grignard fut découverte en 1926 par A. Job qui, avec ses élèves, isola ainsi les hexacarbonyles de chrome et de tungstène.
Vers 1940, on constata que les carbonyles métalliques, et celui de cobalt en particulier, étaient des catalyseurs jouant le rôle de transporteurs d'oxyde de carbone sur des molécules organiques au cours des synthèses « oxo » ; de grandes firmes industrielles prirent vers 1950 des brevets et les mirent en œuvre.
La liste des métaux-carbonyles et de leurs dérivés n'a cessé depuis de s'accroître ; leurs structures, leurs propriétés chimiques ont en effet intéressé au plus haut point un grand nombre de physico-chimistes et de théoriciens.
Classification
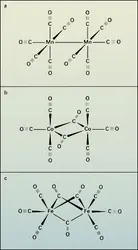
On distingue les carbonyles mono- et polynucléaires. Les premiers ne contiennent qu'un seul atome de métal et toutes les molécules d'oxyde de carbone sont directement liées à ce noyau par l'intermédiaire du carbone qui met en commun un doublet électronique ; en première approximation, la liaison entre le carbone et l'oxygène reste triple (cf. Étude des liaisons). Si l'on excepte le vanadium hexacarbonyle qui est paramagnétique, tous sont diamagnétiques et, de plus, leur nombre atomique effectif de Sidgwick (nombre d'électrons entourant le noyau dans le carbonyle) est égal au numéro atomique d'un gaz rare : 36, 54 ou 86. Il en résulte que le numéro atomique du métal doit être un nombre pair. Les carbonyles polynucléaires contiennent au contraire plusieurs atomes de métal qui peuvent être directement liés par covalence, comme cela existe dans le dimanganèse décacarbonyle, mais aussi être reliés par deux ou trois molécules d'oxyde de carbone, formant des ponts de radical carbonyle bivalent, comme on peut s'en assurer en déduisant de l'étude du spectre d'absorption dans l'infrarouge des fréquences de vibration de C≡O et C=O. Deux exemples sont donnés à la figure (b et c). Le numéro atomique du métal peut être impair. Ces composés sont diamagnétiques, ce qui suggère une liaison entre les deux atomes métalliques.
Le rhodium et l'iridium donnent des carbonyles fortement polymérisés.
Préparations
Les vapeurs des carbonyles métalliques sont très toxiques et il convient d'éviter de les répandre dans l'atmosphère même à faibles concentrations. On prépare les carbonyles de nickel, fer, cobalt, molybdène par synthèse directe. La réaction est favorisée par une augmentation de pression et par le choix d'une température appropriée à la nature du carbonyle recherché.
Le métal doit être en poudre fine et il y a souvent avantage à le préparer en réduisant un de ses oxydes par l'hydrogène.
Pour le fer pentacarbonyle, par exemple, on opère sous une pression d'oxyde de carbone de 10 à 200 atmosphères entre 150 et 200 0C.
Dans le cas du nickel tétracarbonyle, la réaction est favorisée par la pression, mais il peut être intéressant d'opérer à 60 0C à la pression atmosphérique parce que, dans ces conditions, le cobalt ne réagit pas, d'où une bonne séparation de ces deux métaux.
À côté de la synthèse directe, on passe parfois, par chauffage, d'un carbonyle à un autre, plus condensé :

Certains oxydes sont réduits et carbonylés par l'oxyde de carbone sous pression : sous 200 atmosphères, à 250 0C, on observe la réaction :

L'action simultanée de l'oxyde de carbone et d'un accepteur d'halogène sur des halogénures métalliques est une méthode fort utilisée. L'accepteur d'halogène, qui est un réducteur, peut être minéral (cuivre, argent, magnésium, zinc, aluminium, fer, finement divisés ; ou bien lithium, sodium ou magnésium en présence de pyridine ; ou encore aluminohydrure de lithium, sulfures alcalins, hydrosulfite de sodium) ou organique (organo-magnésiens de Grignard en solution dans l'éther, triéthylaluminium, métaux-cétyles, cystéine).
Propriétés physico-chimiques
Les propriétés physiques caractéristiques de tous les carbonyles métalliques, qui ont été isolés, sont réunies dans le tableau. Ces composés covalents ne sont solubles que dans les liquides non polaires.
Les carbonyles métalliques chauffés à l'abri de l'air se décomposent en libérant le métal ; cette pyrolyse est utilisée industriellement pour préparer du nickel et du fer très purs. Chauffés très vite, certains détonent : on a, par exemple, la réaction brutale :

Au contact de l'air, on peut les enflammer ; ils brûlent en donnant du gaz carbonique et des oxydes métalliques :

Les carbonyles de nickel et de fer s'enflamment parfois spontanément au contact de l'air à température ordinaire.
Les réactions de substitution et le passage aux anions carbonylés méritent une étude spéciale.
a) Réactions de substitution. On peut substituer aux molécules terminales d'oxyde de carbone, comme à celles qui forment des ponts entre noyaux métalliques, des atomes d'halogène ou diverses molécules et obtenir ainsi de nombreux dérivés conservant une partie de l'oxyde de carbone.
Une molécule d'halogène peut remplacer une molécule d'oxyde de carbone. Exemples : Fe(CO)4I2, Os(CO)4X2, X étant Cl, Br ou I. Mais il existe un grand nombre de dérivés halogénés et carbonylés qui ne dérivent pas par substitution de carbonyles métalliques. Exemples : Co(CO)I2, Ir(CO)3X, Ru(CO)2X2. De plus, certains métaux (Pd, Pt, Cu, Au) donnent de tels dérivés alors qu'on ne leur connaît pas de carbonyles. Ces composés sont covalents ; ils sont solubles dans les solvants non polaires et leur stabilité croît des chlorures aux iodures. On les obtient par action de l'oxyde de carbone fortement comprimé sur un halogénure métallique ou bien par action de l'halogène sur un carbonyle polynucléaire.
L'oxyde nitrique NO conduit à des nitroso-carbonyles, 2 NO remplaçant 3 CO ; on considère que NO cède d'abord un électron au métal et qu'ensuite l'ion NO+ qui est isoélectrique avec CO se fixe par coordinence grâce au doublet libre sur l'azote. On obtient des séries dans lesquelles le nombre atomique effectif du métal est égal au numéro atomique d'un gaz rare. Exemples : Mn(CO)(NO)3, Fe(CO)2(NO)2, Co(CO)3(NO).
L'ion CN-, les isonitriles ou carbylamines, étant isoélectroniques avec l'oxyde de carbone, peuvent remplacer ce dernier partiellement ou totalement, par action directe sur les carbonyles métalliques, et donner des composés très stables. Exemples : [Ni(CN)2(CO)2]2-, Ni(CO)(CNCH3)3.
Diverses bases azotées : ammoniac, pyridine, phénanthroline-1-10, dipyridyle-2-2′ donnent des dérivés de substitution tels que Fe(CO)3(NH3)2, Fe(CO)2(Pyr)(CN)2, Fe2(CO)4(Pyr)3.
Les trihalogénures PF3, PCl3, SbCl3, les éthers-sels phosphoreux P(OR)3, les phosphines, arsines et stibines tertiaires remplacent partiellement ou totalement l'oxyde de carbone des carbonyles métalliques. Exemples : Ni(PF3)4 et Ni(PCl3)4 décrits par Irvine et Wilkinson et la série de composés Mo(CO)6-nLn dans laquelle L est PCl3, P(OCH3)3 ou P(CH3)3, étudiée par Poilblanc et Bigorgne.
On connaît également quelques dérivés de thiols utilisés en catalyse et de nombreux dérivés de substitution qui font intervenir des liaisons par électrons π appartenant à des éthyléniques, des acétyléniques ou des cycles aromatiques.
b) Réactions avec transfert d'électrons. Un transfert d'électrons fournis par des métaux alcalins ou alcalino-terreux en milieu anhydre permet d'obtenir des anions purement carbonylés, appelés anions carbonylmétalliques, et capables de donner des sels appelés carbonylmétallates. Les premiers de ces anions, qui sont mono- ou polynucléaires, furent découverts en 1931 par Hieber et Leutert.
On a, par exemple, au sein de l'ammoniac liquéfié, la réaction qui conduit au tétracarbonylferrate de sodium :

On utilise fréquemment comme solvants divers liquides organiques (éther, tétrahydrofurane) à basse température.
On peut aussi traiter, comme le fit Hieber, un carbonyle métallique par une solution aqueuse fortement alcaline qui provoque une oxydo-réduction, une partie de l'oxyde de carbone passant alors sous forme d'ion carbonate CO32- (réactions).
Les anions carbonylmétalliques sont dits homogènes lorsqu'ils dérivent d'un seul métal et sont purement carbonylés, par exemple : [V(CO)6]-, [Cr(CO)5]-, [Mn(CO)5]-. Ils sont dits hétérogènes quand ils renferment deux métaux, comme [FeCo3(CO)12]-, ou bien lorsque les groupes ou atomes coordinés au noyau sont différents, par exemple dans [Fe(CO)3(NO)]-.
La perte d'un ou de plusieurs électrons par les carbonyles métalliques donne des cations carbonylmétalliques. Elle est beaucoup plus difficile à obtenir et on n'a pas isolé des composés contenant de tels cations homogènes. On estime cependant que le fer pentacarbonyle dissous dans la butylamine ou la pipéridine subit une dismutation :

De plus, on a isolé des sels du cation hétérogène [Mn(C6H5)(CO)2(NO)]+.
c) Hydrures des métaux carbonyles. En acidifiant, à l'abri de l'air, une solution de carbonylmétallate alcalin, on libère l'acide correspondant à l'anion et on peut l'entraîner par un courant d'oxyde de carbone et le condenser (réactions).
Ces hydrures sont des liquides très volatils, instables même à froid, très réducteurs, qui correspondent à un degré d'oxydation négatif du métal. En solution aqueuse et en présence de bases, ils se comportent souvent comme des acides forts :

En l'absence de base, ils se décomposent en libérant de l'hydrogène et un carbonyle :

Ce sont des transporteurs à la fois d'hydrogène et d'oxyde de carbone et ils catalysent des réactions « oxo » ; on les utilise industriellement.
Klemm a montré qu'ils sont diamagnétiques ; les mesures de spectroscopie infra-rouge et de résonance paramagnétique nucléaire montrent que l'hydrogène est lié directement au métal.
Étude des liaisons
La molécule C ≡ O pourrait se lier au métal M soit à l'aide du doublet électronique libre sur le carbone (moins électronégatif que l'oxygène), soit à l'aide des électrons π de la triple liaison ; le fait que les trois atomes M, C et O soient alignés se prononce en faveur de la première hypothèse. On a admis, comme première approximation, l'existence d'une liaison de covalence dative (ou coordinence), le métal jouant le rôle d'accepteur. Mais la réalité est plus complexe. D'une part, le métal est un acide de Lewis faible et l'oxyde de carbone une base de Lewis faible ; d'autre part, ces liaisons σ apporteraient au métal un excès de charges négatives absolument incompatible avec le principe de neutralité électrique de Pauling. On admet donc qu'il y a combinaison d'une orbitale d du métal avec une orbitale antiliante π de l'oxyde de carbone. Ce transfert d'electrons du métal vers cette orbitale π réduit la distance de M à C, augmente la distance de C à O et diminue la force de liaison entre C et O. Dans le cas du nickel tétracarbonyle, la distance Ni−C est de 0,182 nm au lieu de 0,216, la distance C−O est de 0,115 à 0,116 nm au lieu de 0,113 nm dans l'oxyde de carbone et 0,122 nm dans le carbonyle de l'acétone. Pauling attribuait un caractère de double liaison évalué à environ 78 p. 100 pour la liaison Ni−C ; il proposait une résonance entre cinq structures limites comportant de 0 à 4 doubles liaisons Ni=C. D'où des résonances du type :

Les carbonyles métalliques polynucléaires tels que Co2(CO)8 et Fe2(CO)9 posent un autre problème. Chaque molécule d'oxyde de carbone terminale donne deux électrons à un atome du métal et chaque molécule formant pont fournit un électron à chacun des métaux qu'elle unit. On trouve ainsi 35 électrons autour de chaque atome de cobalt dans le premier cas et 35 électrons autour de chaque atome de fer dans le second. La substance étant diamagnétique, on pense immédiatement à une liaison de covalence entre les deux atomes métalliques ; de plus, on retrouve ainsi une structure de gaz rare, comme le veut la règle de Sidgwick. La distance entre les deux atomes de fer, 0,246 nm, permet d'envisager une telle liaison. Cependant, Ewens fait appel à un couplage des deux électrons célibataires sans qu'il y ait une véritable liaison de covalence. Le plus souvent on indique cette liaison faible par un trait interrompu entre les deux atomes métalliques.
Dioxyde
Le dioxyde de carbone CO2 est souvent appelé gaz ou anhydride carbonique. La molécule est linéaire et symétrique et se conserve sous cette forme dans les trois états de la matière.
Il s'en forme par combustion du carbone et de ses formes industrielles (coke), lors de la dissociation thermique des carbonates, ainsi que dans la fermentation alcoolique et dans la respiration. L'atmosphère a une faible teneur en gaz carbonique : 0,03 p. 100 environ en volume.
L'industrie livre le dioxyde de carbone sous pression et sous forme de solide ou de liquide. La fabrication est la suivante : le gaz carbonique provenant de la combustion de coke est absorbé sélectivement dans une solution d'acides aminés puis libéré très pur : on livre actuellement dans le commerce du dioxyde de carbone contenant seulement 50 p.p.m. d'impuretés.
Le point triple de ce corps correspond à − 56,6 0C et 5,1 atmosphères et son point critique à 31,3 0C et 73 atmosphères. Le gaz carbonique est donc gazeux dans les conditions normales de température et de pression. La détente de l'anhydride carbonique liquéfié sous pression suffit à diminuer assez fortement la température pour qu'une fraction se solidifie en neige carbonique.
La réaction de dissociation en monoxyde ne se manifeste qu'à très haute température et croît avec celle-ci. À 1 227 0C, il n'y a que 0,04 p. 100 de CO2 dissocié à la pression atmosphérique ; la dissociation ne dépasserait 70 p. 100 qu'au-dessus de 3 000 0C pour être presque totale vers 5 000 0C.
Ce dioxyde peut être réduit. Généralement la réduction se fait à une température élevée. Le magnésium chauffé brûle dans CO2 avec formation de magnésie et de carbone ; le calcium, le zinc, l'aluminium et d'autres métaux réducteurs agissent sur le gaz à une température suffisamment élevée.
Comme le carbone, le phosphore en présence d'un alcali, le silicium et le bore réduisent le dioxyde au rouge.
Avec l'hydrogène, à température élevée, la réaction limitée :


L' eau qui a dissous du dioxyde de carbone a des propriétés faiblement acides. On estime que cette solution est le siège de réactions dues à un diacide très faible non isolé dont la formule correspondrait à H2CO3.
On a établi deux mécanismes de réaction du dioxyde sur l'eau :
a) pour un pH inférieur à 8 :


b) pour un pH supérieur à 10 :


Avec l'ammoniac à froid, on forme le carbamate d'ammonium :

On connaît des sels (carbonates bimétalliques et carbonates monacides), des esters et diesters, le chlorure d'acide, la diamide (l'urée CO(NH2)2), des sels de monamide (carbamate d'ammonium), l'imide diamide (guanidine HN=C(NH2)2.
Les solutions aqueuses d'anhydride carbonique possèdent les propriétés des acides faibles. Elles attaquent le magnésium et quelques autres métaux et jouent un rôle actif dans la rouille du fer bien que cette rouille puisse être produite en l'absence de gaz carbonique.
En plus des métacarbonates, des carbonates « neutres » M2CO3 et des carbonates acides MHCO3, il existe encore des sesquicarbonates MHCO3, M2CO3, des carbonates basiques, des carbonates doubles et des complexes minéraux où l'ion CO32- est dissimulé (M est le symbole d'un métal monovalent).
Tous les carbonates sont dissociables par la chaleur et il s'établit un équilibre du type :

Les carbonates alcalins ne se dissocient qu'à très haute température, les carbonates alcalino-terreux et le carbonate de lithium à température moins élevée ; la température à laquelle une pression déterminée de CO2 est atteinte décroît du carbonate de baryum au carbonate de magnésium, en passant par le strontium puis le calcium. Les carbonates alcalins solubles dans l'eau sont hydrolysés.
Les carbonates métalliques ne sont connus que pour des métaux suffisamment électropositifs.
Le carbonate acide de sodium peu soluble dans l'eau est à la base du procédé industriel de préparation du carbonate de sodium (procédé Solvay).
Un barbotage de gaz carbonique dans une saumure ammoniacale donne un précipité de carbonate acide de sodium :

Le carbonate acide chauffé modérément se décompose :

Sulfure de carbone
Le sulfure de carbone est obtenu par action directe du soufre sur le carbone au rouge vers 900 à 1 000 0C. La réaction est très endothermique (ΔH = 117 kJ . mol-1). Le sulfure de carbone est un corps très inflammable :

C'est un réducteur. À 500 0C en présence de catalyseur (magnésie + charbon) on a la réaction :

Il peut aussi donner des réactions d'addition où il joue un rôle analogue à un anhydride ; ainsi, avec un sulfure alcalin, il y a formation d'un thiocarbonate d'ailleurs peu stable :

Le sulfure de carbone réagit avec l'alcalicellulose (cellulose traitée par une lessive de soude à 20 p. 100) en donnant un produit visqueux appelé viscose qui est une solution de xanthogénates de cellulose et de sodium d'où la cellulose est libérée par action d'un acide.
On appelle acides xanthiques ou xanthogéniques les acides de formule générale : S=C(SH)OR, où R est un radical alcoyle (CnH2n+1). Ainsi la potasse alcoolique réagit sur le sulfure de carbone en donnant un xanthogénate de potassium de formule : S=C(SK)OC2H5.
Le sulfure de carbone est un excellent solvant des caoutchoucs, des résines, des huiles et graisses animales et végétales. Mais sa volatilité (te = 46,3 0C), son inflammabilité et sa toxicité imposent de sévères mesures de sécurité partout où il est employé. L' intoxication chronique provoque surtout des troubles psychiques (insomnie, irritabilité) mais l'absorption massive peut être mortelle.
Composés azotés
Le cyanogène (CN)2 est un gaz qui peut être préparé au laboratoire par chauffage au rouge du cyanure de mercure ou d'un mélange de cyanure alcalin et de chlorure mercurique.
Il s'unit à l'hydrogène pour donner l'acide cyanhydrique HCN. Combustible, il brûle en donnant de l'azote et, selon la quantité d'oxygène, du gaz carbonique ou de l'oxyde de carbone. Son hydratation est catalysée par les acides et fournit divers produits. En présence de bases, le cyanogène réagit comme un halogène et donne un mélange de sels d'hydracide et d'acide oxygéné :

Sous l'action de rayons ultraviolets, le cyanogène se polymérise en paracyanogène (CN)x qui est un solide noir. Ce paracyanogène, chauffé en vase clos, se transforme en cyanogène par une réaction limitée et réversible.
L'acide cyanhydrique anhydre HCN est un liquide incolore très toxique : c'est un inhibiteur des phénomènes d'oxydo-réduction cellulaires. Il agit plus spécialement au niveau des cytochromes.
Dans les intoxications suraiguës (chambre à gaz), l'intoxiqué s'effondre et meurt en quelques minutes avec quelques mouvements convulsifs.
Au laboratoire, on l'obtient en attaquant un ferro-cyanure alcalin par l'acide sulfurique étendu (réaction).
Ce corps est une étape dans la synthèse de polymères (fibres acryliques, élastomères, plastiques) et il est fabriqué dans l'industrie par oxydation catalytique d'un mélange d'ammoniac, de méthane et d'oxygène à 1 000 0C en présence de platine.
L'acide cyanhydrique brûle dans l'air et peut détoner au contact d'une flamme lorsqu'il est mélangé à de l'oxygène.
Il forme avec l'eau des solutions d'acide faible. On connaît de nombreux sels métalliques de cet acide, ce sont les cyanures qui peuvent être simples ou complexes. Ils sont très employés dans l'industrie, dans les bains de galvanoplastie et la concentration des minerais, par flottation notamment. Les cyanures des métaux alcalins et alcalino-terreux et du mercure sont seuls solubles dans l'eau. Les cyanures peu solubles dans l'eau sont en général solubilisés dans un excès de cyanure soluble en formant des complexes. Les cyanures sont réducteurs et s'oxydent en cyanates :

Carbures métalliques
Il n'existe pas de composés contenant le cation C4+ mais différents composés solides cristallisés qui sont des molécules géantes dans lesquelles les liaisons ont un certain caractère ionique. Outre les solides binaires qui peuvent être considérés comme des composés d'insertion du graphite (cf. Composés d'insertion), on en connaît d'autres où le carbone garnit les interstices d'un réseau métallique, et aussi quelques carbures où le carbone paraît lié à ses voisins par quatre liaisons analogues à celle que cet atome établit avec des atomes de carbone dans le diamant.
Le groupe important des carbures, où une association discrète de deux atomes de carbone paraissant constituer un ion (C≡C)2- peut être structuralement distinguée, contient des carbures Na2C2, CaC2, BeC2, MgC2, ZnC2, CdC2, HgC2, Al2(C2)3, Cu2C2, Ag2C2, Au2C2, LaC2, des carbures homologues de métaux de terres rares, UC2, ThC2, VC2.
Un certain nombre de ces carbures sont obtenus par réaction de l'acétylène sur un dérivé métallique convenable, quelques-uns par action du carbone sur l'oxyde (ce qui est le cas par exemple pour UC2 ou CaC2).
L'action de l'eau ou de l'acide chlorhydrique dilué redonne souvent l'acétylène. CdC2 est inerte à l'action de l'eau. UC2 et ThC2 donnent un mélange d'hydrocarbures, et, dans les mêmes conditions, B2C et Al4C3 du méthane.
Le carbure de silicium est formé par action à chaud du silicium sur le carbone ou par réduction de la silice par un excès de carbone ; il en est de même du carbure B4C. Ces carbures sont des corps thermiquement stables, durs et chimiquement inertes. On connaît trois formes du carbure de silicium rattachables respectivement au diamant, à la blende et à la wurtzite. Les atomes de carbone et de silicium y alternent et y jouent des rôles homologues.
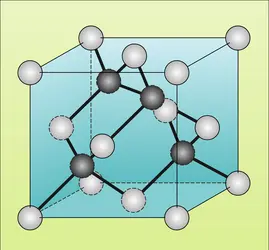
Les carbures métalliques interstitiels forment un groupe très important. Les atomes métalliques ont dans ce cas une structure compacte et les atomes de carbone viennent occuper les interstices octaédriques de cette structure. Les carbures acquièrent ainsi la structure du chlorure de sodium. Ils sont obtenus par chauffage du carbone et du métal en poudre vers 2 200 0C. D'aspect métallique, ils ont une conductivité électrique élevée et sont souvent très durs. Les principaux sont TiC, ZrC, HgC, VC, V2C, NbC, TaC, W2C, WC, Mo2C et MoC.
Quelques métaux de transition, Cr, Mn, Fe, Co et Ni ont des rayons atomiques si petits qu'ils ne rendent pas possible la formation de carbures interstitiels. Ils donnent naissance aux carbures Cr3C2, Mn3C, Fe3C, Co3C et Ni3C.
Le carbure de chrome est inerte et résiste aux acides et aux bases. Le carbure de manganèse réagit avec l'eau pour donner un gaz formé de 75 p. 100 d'hydrogène et aussi de méthane et d'éthane. La cémentite Fe3C est décomposée par l'eau avec formation d'éthane, d'éthylène et d'hydrocarbures plus complexes. Ni3C est beaucoup moins stable que la cémentite et l'existence de Co3C n'a été révélée que par l'analyse thermique du système cobalt-carbone.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean AMIEL : ancien élève de l'École nationale supérieure de physique et de chimie de Paris, agrégé de physique, professeur honoraire de chimie générale à l'université de Paris-VI-Pierre-et-Marie-Curie
- Henry BRUSSET : docteur ès sciences, professeur honoraire de l'université de Paris-VI et de l'École centrale des arts et manufactures
Classification
Médias
Autres références
-
ACIER - Technologie
- Écrit par Louis COLOMBIER , Gérard FESSIER , Guy HENRY et Joëlle PONTET
- 14 178 mots
- 10 médias
Cette existence des deux variétés allotropiques du fer joue un grand rôle pour les propriétés de l'acier.Le fait essentiel réside dans la différence de solubilité du carbone dans chacune de ces formes. Alors que cette solubilité du carbone est nulle ou extrêmement faible dans le fer α, elle est... -
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 363 mots
- 5 médias
...soumises aux plus gros efforts dans les trains d'atterrissage des avions (cf. acier – Technologie). L'acier le plus simple est un alliage de fer et de carbone, renfermant moins de 2 p. 100 en poids de carbone (9 atomes pour 100). Il faut rappeler que le carbone n'est pas lui-même un métal, mais que le... -
ASTROCHIMIE
- Écrit par David FOSSÉ et Maryvonne GERIN
- 4 390 mots
- 3 médias
...hydrocarbures simples subsistent malgré les conditions de rayonnement. On s'aperçoit donc que les chemins de la synthèse moléculaire dans l'espace sont variés. Il existe cependant un dénominateur commun aux espèces détectées dans le milieu interstellaire : elles contiennent pratiquement toutes du carbone. Comme... -
AUTOTROPHIE & HÉTÉROTROPHIE
- Écrit par Alexis MOYSE
- 2 504 mots
- 2 médias
Lecarbone minéral assimilable étant sous la forme de gaz carbonique ou d'ions carbonate ou bicarbonate, l'autotrophie complète suppose la capacité de fixer ces substances et de les réduire, c'est-à-dire de passer du composé CO2 à des constituants dans lesquels les atomes de carbone,... - Afficher les 48 références
Voir aussi
- PYROCARBONE
- SULFURE DE CARBONE
- TÉTRACHLORURE DE CARBONE
- PHOSGÈNE (oxychlorure de carbone)
- BOUDOUART RÉACTION DE
- SABATIER & SENDERENS RÉACTION DE
- CARBONIQUE ACIDE
- CARBONATE DE SODIUM
- XANTHIQUES ACIDES
- CYANOGÈNE
- CARBONYLES MÉTALLIQUES
- ISOTOPES
- RADIOÉLÉMENTS ou RADIONUCLÉIDES ou ISOTOPES RADIOACTIFS
- EAU, physico-chimie
- DATATION RADIOCHRONOLOGIQUE ou ISOTOPIQUE, géologie
- CARBONE 14 DATATION PAR LE
- COMPOSÉS D'INSERTION
- SUBSTITUTION, chimie
- HYDRURES
- CARBURES
- HALOGÉNÉS DÉRIVÉS
- SYNTHÈSE DES CRISTAUX ou CRISTALLOGENÈSE, technologie
- ADDITION, chimie
- OXYDATION
- GRAPHITE
- CYANURES
- CARBONE 14
- OXYCHLORURES
- SOLVAY PROCÉDÉ
- CONFIGURATION ÉLECTRONIQUE
- ALLOTROPIE
- CYANHYDRIQUE ACIDE
- OXYDES
- HALOGÉNURES
- FLUORURES
- MONOXYDE DE CARBONE ou OXYDE DE CARBONE (CO)
- NOIR DE CARBONE
- HYDROFORMYLATION ou RÉACTION OXO
- CARBONIQUE GAZ ou DIOXYDE DE CARBONE
- TRANSFERT D'ÉLECTRONS
- CARBURE DE SILICIUM