CATALYSE
Article modifié le
Le terme catalyse a été forgé par Berzelius en 1835 pour désigner l'ensemble des effets chimiques produits par les catalyseurs. On appelle catalyseur « toute substance qui altère la vitesse d'une réaction chimique sans apparaître dans les produits finaux » (Ostwald, 1902). La catalyse est donc une branche de la cinétique chimique qui, de façon plus générale, étudie l'influence de tous les facteurs physiques ou chimiques déterminant les vitesses de réaction.
La notion de catalyseur est intuitive et elle est passée dans le langage courant pour désigner, par exemple, une personne physique ou morale provoquant par son action ou son exemple une importante transformation politique ou sociale, dont elle n'est pas le moteur.
La définition du catalyseur s'est précisée peu à peu et s'est progressivement distinguée de celle assez voisine de l' initiateur.
Un initiateur est une substance qui produit aussi l'accélération de certains processus chimiques, mais, ce faisant, il est nécessairement détruit. Les peroxydes organiques sont, par exemple, des initiateurs de la polymérisation du styrolène liquide en polystyrènes solides (matières plastiques).
Il en est de même des inhibiteurs, improprement nommés catalyseurs négatifs, ou anticatalyseurs, qui ralentissent fortement ou même suppriment certaines réactions. Des antioxygènes tels que les alcoylphénols inhibent l'oxydation du caoutchouc par l'oxygène de l'air.
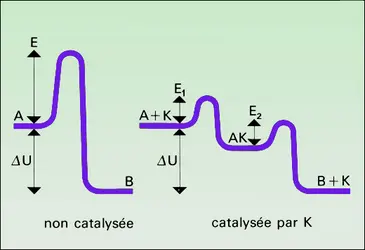
Les peroxydes initiateurs et les alcoylphénols sont consommés et chimiquement dénaturés au cours de leur action. Au contraire, un catalyseur reste identique à lui-même au cours de la catalyse et peut ainsi, en principe, être indéfiniment réutilisé. Par exemple, le platine ou le palladium divisés catalysent la combinaison des gaz hydrogène et oxygène en eau (Davy, 1817). Moyennant certaines précautions, ces catalyseurs peuvent provoquer la combinaison de quantités aussi grandes que l'on veut d'hydrogène et d'oxygène.
En pratique néanmoins, par suite de réactions parasites, le catalyseur a une durée de vie limitée ; son action s'affaiblit au cours du temps et s'interrompt complètement au bout de quelques heures ou de quelques années. Cette désactivation n'est pas intrinsèquement liée au mécanisme de la catalyse, mais à des effets physiques (haute température) ou chimiques (présence d'impuretés) parfois réversibles, la réactivation étant alors possible par des procédés simples. La longévité d'un catalyseur peut être mesurée par la quantité de matière qu'il a transformée par unité de masse avant sa disparition : ce rapport théoriquement infini est souvent très élevé (102 à 106). S'il est très faible (quelques unités), on peut se demander s'il y a vraiment catalyse.
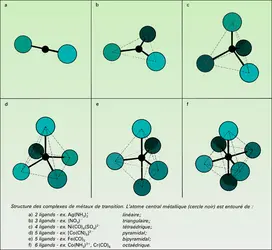
On distingue la catalyse homogène et la catalyse hétérogène ; dans le premier cas, le catalyseur est dissous dans le milieu (gaz ou liquide) où se produit la réaction ; dans le second, le catalyseur est un solide au contact de ce milieu, d'où le nom de catalyse de contact. La séparation du catalyseur des produits de la réaction est alors grandement simplifiée.
L'importance pratique de la catalyse dans l'industrie chimique est considérable. Presque tous les produits de grande consommation sont passés par une catalyse à un ou plusieurs stades de leur élaboration : essences et huiles de voiture (cracking, reforming, hydrofining), détergents (alcoylation), caoutchoucs, matières plastiques et fibres synthétiques (synthèse des monomères et polymérisation) et même notre pain quotidien, qui, produit direct d'une catalyse enzymatique, est le produit indirect des engrais azotés de synthèse (catalyse de l'ammoniac).
Thermodynamique et catalyse
L' effet du catalyseur ne peut être que cinétique ; par définition, il se retrouve en effet intact en fin de réaction : sa présence ne peut donc modifier les grandeurs thermodynamiques caractéristiques (variations d'enthalpie ΔH0, d'enthalpie libre ΔG0) et la constante d'équilibre liée à ces grandeurs. Les conséquences de cette remarque sont très importantes. En premier lieu, il ne faut pas espérer obtenir, en présence d'un catalyseur, une réaction thermodynamiquement impossible dans les conditions de l'expérience (ΔG0 positif et grand). Ainsi, dans les conditions habituelles, la combinaison de l'azote et de l'oxygène de l'air en oxydes d'azote (N2O, NO, NO2) ne peut se faire, quel que soit le catalyseur envisagé, circonstance heureuse pour notre espèce. En revanche, la combinaison de l'hydrogène et de l'oxygène est possible, mais sa vitesse est nulle dans les mêmes circonstances, sauf en présence d'un catalyseur adéquat. Celle de l'azote et de l'hydrogène en ammoniac l'est aussi, mais, jusqu'à ce jour, aucun catalyseur n'a été trouvé capable de lui donner une vitesse notable au voisinage de la température ambiante. Cet important problème n'est pas résolu, mais il n'est pas insoluble.
En deuxième lieu, puisque le catalyseur ne peut déplacer la position finale d'un équilibre chimique, mais qu'il diminue fortement le temps nécessaire pour l'atteindre, c'est qu'il accélère dans le même rapport les vitesses des deux réactions inverses dont l'égalité est la condition de l'équilibre. Ainsi, le même catalyseur doit accélérer la synthèse et la décomposition de l'ammoniac en ses éléments, le fer par exemple. On peut alors trouver le catalyseur d'une réaction donnée en recherchant le catalyseur de la réaction inverse, pour les couples hydrogénation-déshydrogénation, hydratation-déshydratation. Pour la même raison, l'influence de la quantité de catalyseur (plus précisément de sa concentration) sur les deux réactions inverses doit s'exprimer par la même loi, et les formules cinétiques exprimant leurs vitesses doivent contenir les produits de concentrations de la loi d'action de masse.
Soit la réaction :


Pour que ces deux conditions soient identiques, on peut avoir :


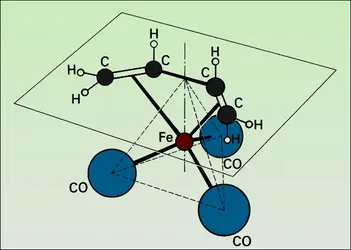
Dans tous les cas très simples qui précèdent, l'évolution du système chimique initial est pratiquement univoque. Mais, dans beaucoup d'autres cas, le système peut évoluer dans plusieurs directions thermodynamiquement permises ; cette situation est particulièrement fréquente avec les composés du carbone (chimie organique). Un catalyseur approprié peut alors accélérer de préférence une seule de ces évolutions, et cette sélectivité est une propriété souvent plus précieuse que l'effet accélérateur global, qui mesure son activité. Par exemple, un mélange gazeux d'oxyde de carbone et d'hydrogène peut, suivant le catalyseur choisi, être converti en méthane (nickel), méthanol (oxyde de zinc), ou n-alcanes (synthèse Fischer-Tropsch, catalyseur au cobalt).
Cela ne contredit nullement la thermodynamique, et un catalyseur très sélectif permet l'étude d'équilibres partiels qui seraient, en son absence, noyés dans un système très compliqué de réactions parallèles ou successives. On conçoit aisément l'importance pratique de cette sélectivité dans les synthèses industrielles.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Henri Jean-Marie DOU : ingénieur I.P.S.O.I., docteur ès sciences, directeur de recherche au C.N.R.S., au Centre de recherche rétrospective de Marseille, président de la Société française de bibliométrie appliquée
- Jean-Eugène GERMAIN : professeur de chimie à l'université de Lyon-I-Claude-Bernard
Classification
Médias
Autres références
-
ABZYMES
- Écrit par Joël CHOPINEAU , Encyclopædia Universalis , Alain FRIBOULET , Sabine PILLE et Daniel THOMAS
- 1 038 mots
Le concept d'anticorps catalytique, ou abzyme (contraction d’antibodyet enzyme), fut énoncé dès les années 1940 par Linus Pauling. S’appuyant sur le fait que la réaction chimique de transformation d'une molécule en une autre passe par un état de transition, qui représente...
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 367 mots
- 7 médias
Certaines réactions sont accélérées par la présence de substances étrangères (fréquemment il suffit de très faibles quantités), que l'on trouve inchangées en fin de réaction et que l'on nomme catalyseurs. Lorsqu'en solution le catalyseur est constitué par les ions H+ ou OH... -
ANTIOXYGÈNES
- Écrit par Robert PANICO
- 2 341 mots
- 2 médias
...irradiation ultraviolette : l'absorption d'énergie lumineuse par la substance autoxydable facilite la rupture de la liaison R—H ; — par action de catalyseurs : les peroxydes organiques, en particulier le peroxyde de benzoyle, fournissent, par décomposition thermique, des radicaux... -
ARGILES
- Écrit par Daniel BEAUFORT et Maurice PAGEL
- 2 655 mots
- 7 médias
L' origine de la vie pourrait se trouverdans les propriétés catalytiques des surfaces des minéraux argileux qui auraient favorisé la polymérisation de molécules organiques complexes capables de donner naissance à des structures moléculaires aussi complexes que l'ARN. Les phyllosilicates... - Afficher les 24 références
Voir aussi
- CARBONYLES MÉTALLIQUES
- CARBÈNES
- POLYMÉRISATION
- ÉTHYLÈNE
- ENZYMES
- HYDROLYSE
- RÉACTIONNELS MÉCANISMES
- BASE, chimie
- CATALYSE ENZYMATIQUE
- CATALYSE HOMOGÈNE
- CATALYSE HÉTÉROGÈNE
- HAMMETT FONCTION DE
- INHIBITEURS, chimie
- FORCE D'UN ACIDE ou D'UNE BASE
- ÉQUILIBRE, chimie
- CATALYSEURS
- HYDROXYLE ou OXHYDRYLE
- VITESSE DE RÉACTION
- CHIMISORPTION
- LIGAND ou COORDINAT, chimie
- FRIEDEL & CRAFTS CATALYSEUR DE
- HYDROGÉNATION
- ACTIVATION, chimie
- CENTRE ACTIF, chimie
- AIRE SPÉCIFIQUE
- AUTO-INHIBITION, chimie
- THERMODYNAMIQUE CHIMIQUE
- PROMOTEUR, chimie
- OXYDATION
- INITIATEUR, chimie
- FRITTAGE
- NUCLÉOPHILES SUBSTITUTIONS
- PLATINE
- SOLIDES PHYSIQUE DES
- SAPONIFICATION
- AMMONIUM QUATERNAIRE
- TRANSITION MÉTAUX DE
- OXYDES
- MONOXYDE DE CARBONE ou OXYDE DE CARBONE (CO)
- RÉACTIVITÉ CHIMIQUE
- ACIDITÉ ÉCHELLE D'
- SÉLECTIVITÉ, chimie
- CATALYSE TRANSFERT DE PHASE PAR