CATALYSE
Article modifié le
Mécanisme général de l'action des catalyseurs
Le mot catalyse a longtemps servi à cacher l'ignorance complète où se trouvaient les chimistes devant certains phénomènes inexplicables. L'action des catalyseurs entre en fait dans le cadre général de l'étude des mécanismes réactionnels, c'est-à-dire de la recherche des étapes successives par lesquelles les molécules des corps mis en réaction se transforment pour donner les produits finaux.
Ces étapes comportent chacune la rupture ou la formation d'un petit nombre de liaisons chimiques entre atomes, et mettent souvent en jeu des intermédiaires très instables et rarement isolables, comme les radicaux libres ou les ions.
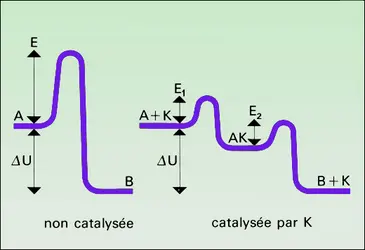
La présence du catalyseur modifie le mécanisme réactionnel et ouvre à la transformation une voie souvent plus complexe mais finalement plus rapide, comportant des étapes à faible énergie d'activation. Cela n'est possible que dans la mesure où le catalyseur est lui-même un réactif pour une ou plusieurs de ces étapes, et un produit pour une ou plusieurs autres : il est donc constamment consommé et régénéré au cours de la catalyse, et il ne reste intact qu'en apparence. Cela est illustré schématiquement dans la figure 1.
Généralement, le catalyseur réagit avec les molécules de réactif les plus inertes (stables) et les fait entrer dans le cycle réactionnel ; c'est ce que l'on exprime en disant que le catalyseur active ces molécules. Ainsi, un catalyseur d'oxydation « active » la molécule d'oxygène, un catalyseur d'hydrogénation celle d'hydrogène. Cette activation comporte ou non une dissociation de la molécule activée. Les atomes du catalyseur sur lesquels portent ces réactions sont appelés centres actifs.
Les étapes ultérieures libèrent les centres actifs, qui deviennent ainsi à nouveau disponibles pour recommencer le cycle. Par exemple, la molécule à oxyder ou à hydrogéner réagit avec l'oxygène ou l'hydrogène lié au catalyseur. Elle peut elle-même avoir été au préalable activée par un processus semblable. La nature et la réactivité des intermédiaires résultant de la réaction des centres actifs avec les molécules initiales déterminent l'activité et la sélectivité du catalyseur.
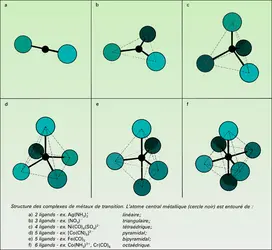
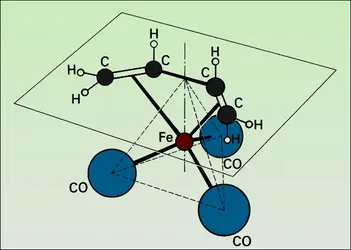
Il est relativement facile d'identifier les centres actifs et les espèces intermédiaires dans la catalyse homogène, par les méthodes habituelles de la chimie. La tâche est beaucoup plus difficile en catalyse hétérogène, car ces centres actifs font partie de la surface d'un solide, auquel ils restent liés, mais l'existence de ces centres est bien connue, et elle explique notamment les phénomènes d'adsorption chimique. Toutefois, le rapprochement entre catalyses homogène et hétérogène, et l'emploi des méthodes physico-chimiques les plus modernes permettent d'affirmer que les différences entre ces deux classes de phénomènes ne sont pas aussi grandes que l'on avait pensé.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Henri Jean-Marie DOU : ingénieur I.P.S.O.I., docteur ès sciences, directeur de recherche au C.N.R.S., au Centre de recherche rétrospective de Marseille, président de la Société française de bibliométrie appliquée
- Jean-Eugène GERMAIN : professeur de chimie à l'université de Lyon-I-Claude-Bernard
Classification
Médias
Autres références
-
ABZYMES
- Écrit par Joël CHOPINEAU , Encyclopædia Universalis , Alain FRIBOULET , Sabine PILLE et Daniel THOMAS
- 1 038 mots
Le concept d'anticorps catalytique, ou abzyme (contraction d’antibodyet enzyme), fut énoncé dès les années 1940 par Linus Pauling. S’appuyant sur le fait que la réaction chimique de transformation d'une molécule en une autre passe par un état de transition, qui représente...
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 367 mots
- 7 médias
Certaines réactions sont accélérées par la présence de substances étrangères (fréquemment il suffit de très faibles quantités), que l'on trouve inchangées en fin de réaction et que l'on nomme catalyseurs. Lorsqu'en solution le catalyseur est constitué par les ions H+ ou OH... -
ANTIOXYGÈNES
- Écrit par Robert PANICO
- 2 341 mots
- 2 médias
...irradiation ultraviolette : l'absorption d'énergie lumineuse par la substance autoxydable facilite la rupture de la liaison R—H ; — par action de catalyseurs : les peroxydes organiques, en particulier le peroxyde de benzoyle, fournissent, par décomposition thermique, des radicaux... -
ARGILES
- Écrit par Daniel BEAUFORT et Maurice PAGEL
- 2 655 mots
- 7 médias
L' origine de la vie pourrait se trouverdans les propriétés catalytiques des surfaces des minéraux argileux qui auraient favorisé la polymérisation de molécules organiques complexes capables de donner naissance à des structures moléculaires aussi complexes que l'ARN. Les phyllosilicates... - Afficher les 24 références
Voir aussi
- CARBONYLES MÉTALLIQUES
- CARBÈNES
- POLYMÉRISATION
- ÉTHYLÈNE
- ENZYMES
- HYDROLYSE
- RÉACTIONNELS MÉCANISMES
- BASE, chimie
- CATALYSE ENZYMATIQUE
- CATALYSE HOMOGÈNE
- CATALYSE HÉTÉROGÈNE
- HAMMETT FONCTION DE
- INHIBITEURS, chimie
- FORCE D'UN ACIDE ou D'UNE BASE
- ÉQUILIBRE, chimie
- CATALYSEURS
- HYDROXYLE ou OXHYDRYLE
- VITESSE DE RÉACTION
- CHIMISORPTION
- LIGAND ou COORDINAT, chimie
- FRIEDEL & CRAFTS CATALYSEUR DE
- HYDROGÉNATION
- ACTIVATION, chimie
- CENTRE ACTIF, chimie
- AIRE SPÉCIFIQUE
- AUTO-INHIBITION, chimie
- THERMODYNAMIQUE CHIMIQUE
- PROMOTEUR, chimie
- OXYDATION
- INITIATEUR, chimie
- FRITTAGE
- NUCLÉOPHILES SUBSTITUTIONS
- PLATINE
- SOLIDES PHYSIQUE DES
- SAPONIFICATION
- AMMONIUM QUATERNAIRE
- TRANSITION MÉTAUX DE
- OXYDES
- MONOXYDE DE CARBONE ou OXYDE DE CARBONE (CO)
- RÉACTIVITÉ CHIMIQUE
- ACIDITÉ ÉCHELLE D'
- SÉLECTIVITÉ, chimie
- CATALYSE TRANSFERT DE PHASE PAR