CATALYSE
Article modifié le
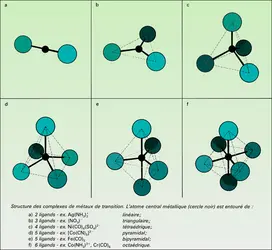
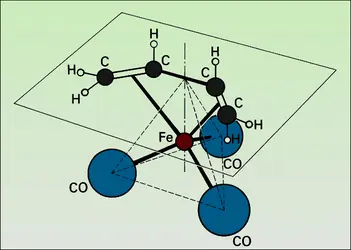
Catalyse homogène
Par définition, le catalyseur est dissous dans le gaz, le liquide ou le solide dans lequel se produit la réaction catalysée. C'est donc un corps à l'état moléculaire, que l'on connaît bien puisque l'opérateur lui-même l'a placé dans le mélange.
Dans un gaz, le catalyseur est forcément une molécule assez simple, ce qui permet de supposer qu'on expliquera facilement le mécanisme : en effet, une molécule très complexe et très lourde ne peut passer facilement à l'état gazeux. En solution, le catalyseur peut être beaucoup plus complexe, et la nature du solvant joue un rôle déterminant. Un cas extrême est celui de la catalyse par les enzymes des principales réactions chimiques accompagnant le fonctionnement des organismes vivants (digestion, respiration). L'activité et la sélectivité de ces catalyseurs naturels dépassent de très loin celles de tous les catalyseurs connus. Leur dimension est telle que l'on se trouve à la limite entre catalyse homogène et hétérogène (plusieurs milliers de fois celle des molécules qu'ils activent).
Mécanisme
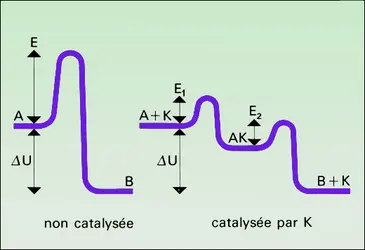
On peut assez souvent, dans les cas simples, séparer la réaction catalytique en deux parties, la première consommant le catalyseur et la deuxième le régénérant. C'est même là un moyen général de « fabriquer » des réactions catalytiques.
Ainsi, vers 600 0C, la vapeur d' iode s'empare de l'hydrogène des alcanes pour former de l'acide iodhydrique et des alcènes ou des hydrocarbures dérivés du benzène, de rapport H/C plus faible. D'autre part, l'oxygène attaque l'acide iodhydrique en lui arrachant son hydrogène, pour former de l'eau et de l'iode. On conçoit que, dans les conditions choisies pour que ces deux réactions aient lieu à la même vitesse, l'iode soit un catalyseur de déshydrogénation des alcanes par l'oxygène, puisque :

L'une des plus anciennes fabrications de l'industrie chimique, celle de l'acide sulfurique par le procédé des chambres de plomb, illustre la catalyse d'oxydation du gaz sulfureux par l'air en présence d'oxyde azotique (Clément et Desormes, 1806), schématisée de la même façon :

Les deux réactions mises en jeu sont connues et rapides dès la température ambiante, alors que l'oxydation directe du gaz sulfureux par l'air est extrêmement lente à la température des chambres, voisine de 60 0C.
Le problème technique le plus sérieux qui se pose dans ces catalyses est la récupération du catalyseur et la ré-injection dans le réacteur, car toute perte doit être compensée par l'addition de catalyseur frais, ce qui grève le prix de revient du produit. Dans les exemples précédents, l'iode peut être séparé de l'hydrocarbure par lavage à l'eau alcalinisée, tandis que l'oxyde azotique est retenu par lavage à l'acide sulfurique de l'air en excès sortant des chambres de plomb (tour de Gay-Lussac)... Cette recirculation du catalyseur complique beaucoup la technologie de la réaction catalysée.
Au point de vue scientifique, les schémas précédents ne sont qu'une ébauche très sommaire des mécanismes réactionnels, car chacune des deux réactions écrites comporte en fait plusieurs étapes.
Les acides et les bases
Les acides et les bases sont les plus simples des catalyseurs de la phase liquide, et les plus anciennement connus.
L'acide sulfurique concentré[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Henri Jean-Marie DOU : ingénieur I.P.S.O.I., docteur ès sciences, directeur de recherche au C.N.R.S., au Centre de recherche rétrospective de Marseille, président de la Société française de bibliométrie appliquée
- Jean-Eugène GERMAIN : professeur de chimie à l'université de Lyon-I-Claude-Bernard
Classification
Médias
Autres références
-
ABZYMES
- Écrit par Joël CHOPINEAU , Encyclopædia Universalis , Alain FRIBOULET , Sabine PILLE et Daniel THOMAS
- 1 038 mots
Le concept d'anticorps catalytique, ou abzyme (contraction d’antibodyet enzyme), fut énoncé dès les années 1940 par Linus Pauling. S’appuyant sur le fait que la réaction chimique de transformation d'une molécule en une autre passe par un état de transition, qui représente...
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 367 mots
- 7 médias
Certaines réactions sont accélérées par la présence de substances étrangères (fréquemment il suffit de très faibles quantités), que l'on trouve inchangées en fin de réaction et que l'on nomme catalyseurs. Lorsqu'en solution le catalyseur est constitué par les ions H+ ou OH... -
ANTIOXYGÈNES
- Écrit par Robert PANICO
- 2 341 mots
- 2 médias
...irradiation ultraviolette : l'absorption d'énergie lumineuse par la substance autoxydable facilite la rupture de la liaison R—H ; — par action de catalyseurs : les peroxydes organiques, en particulier le peroxyde de benzoyle, fournissent, par décomposition thermique, des radicaux... -
ARGILES
- Écrit par Daniel BEAUFORT et Maurice PAGEL
- 2 655 mots
- 7 médias
L' origine de la vie pourrait se trouverdans les propriétés catalytiques des surfaces des minéraux argileux qui auraient favorisé la polymérisation de molécules organiques complexes capables de donner naissance à des structures moléculaires aussi complexes que l'ARN. Les phyllosilicates... - Afficher les 24 références
Voir aussi
- CARBONYLES MÉTALLIQUES
- CARBÈNES
- POLYMÉRISATION
- ÉTHYLÈNE
- ENZYMES
- HYDROLYSE
- RÉACTIONNELS MÉCANISMES
- BASE, chimie
- CATALYSE ENZYMATIQUE
- CATALYSE HOMOGÈNE
- CATALYSE HÉTÉROGÈNE
- HAMMETT FONCTION DE
- INHIBITEURS, chimie
- FORCE D'UN ACIDE ou D'UNE BASE
- ÉQUILIBRE, chimie
- CATALYSEURS
- HYDROXYLE ou OXHYDRYLE
- VITESSE DE RÉACTION
- CHIMISORPTION
- LIGAND ou COORDINAT, chimie
- FRIEDEL & CRAFTS CATALYSEUR DE
- HYDROGÉNATION
- ACTIVATION, chimie
- CENTRE ACTIF, chimie
- AIRE SPÉCIFIQUE
- AUTO-INHIBITION, chimie
- THERMODYNAMIQUE CHIMIQUE
- PROMOTEUR, chimie
- OXYDATION
- INITIATEUR, chimie
- FRITTAGE
- NUCLÉOPHILES SUBSTITUTIONS
- PLATINE
- SOLIDES PHYSIQUE DES
- SAPONIFICATION
- AMMONIUM QUATERNAIRE
- TRANSITION MÉTAUX DE
- OXYDES
- MONOXYDE DE CARBONE ou OXYDE DE CARBONE (CO)
- RÉACTIVITÉ CHIMIQUE
- ACIDITÉ ÉCHELLE D'
- SÉLECTIVITÉ, chimie
- CATALYSE TRANSFERT DE PHASE PAR