CATALYSE
Article modifié le
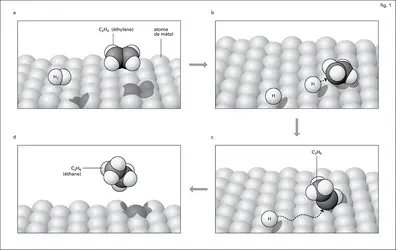
Catalyse hétérogène
L' action d'un solide qui reste en apparence inaltéré sur la vitesse des réactions chimiques dans un gaz ou un liquide à son contact est restée longtemps inexplicable et hétérogène. C'est pourquoi la catalyse hétérogène, ou catalyse de contact, a été pendant longtemps traitée indépendamment de la catalyse homogène. L'ignorance de la nature physicochimique exacte d'un solide et de sa structure ajoutait à la difficulté ; le catalyseur solide ressemblait assez à la « pierre philosophale », qu'on pensait capable de transmuter en or plusieurs millions de fois son poids de vil métal. Les applications industrielles de la catalyse par les solides ont été développées, bien avant que leurs études scientifiques aient abouti à des résultats positifs, et ce fait n'a pas peu contribué à prolonger jusqu'à nos jours cette attitude d'esprit peu rationnelle.
Cependant, dès le début du xxesiècle, les chimistes et les physiciens s'accordaient à reconnaître la nature chimique de la catalyse de contact.
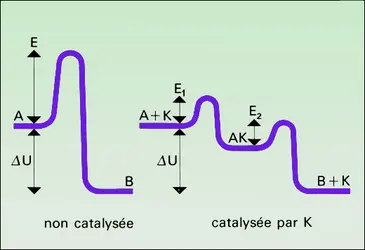
Sabatier écrivait en 1911 : « La catalyse nous semble donc en général résulter de phénomènes purement chimiques accomplis grâce à la présence du catalyseur qui donne, avec l'un des éléments du système primitif, une combinaison temporaire instable dont la destruction ou la réaction rapide sur les autres éléments déterminent la transformation du système, le catalyseur étant régénéré semblable à lui-même, capable de poursuivre indéfiniment le même effet. » Ce point de vue était opposé à l'explication dite « physique » de la catalyse par l' adsorption dans les pores du solide, qui provoquerait une concentration locale élevée de réactifs. Nous savons maintenant que les phénomènes d'adsorption sont complexes, et qu'il faut distinguer la rétention des molécules à la surface de tous les solides par des forces de Van der Waals analogues aux forces qui s'exercent entre les molécules d'un gaz ou d'un liquide – forces faibles et peu spécifiques – de l'adsorption chimique qui est très énergique et très spécifique, car elle crée des liaisons chimiques entre la molécule et les atomes superficiels du solide. Cette chimisorption crée les combinaisons temporaires instables dont parle Sabatier, et active la molécule, qui reste dans son état normal lors de l'adsorption purement physique. Langmuir écrivait vers la même époque :
« Les atomes formant la surface d'un solide sont liés à ceux des couches inférieures par des forces semblables à celles qui s'exercent entre les atomes de la partie interne. Depuis les travaux de Bragg sur la structure cristalline corroborés par de nombreuses autres considérations nous savons que ces forces sont de nature chimique. Dans la couche superficielle, à cause de l'asymétrie des conditions, l'arrangement des atomes doit être toujours légèrement différent de celui de l'intérieur. Ces atomes sont chimiquement insaturés et donc environnés d'un intense champ de forces. »
« D'autres considérations m'amenèrent à penser que, lorsque les molécules de gaz entrent en collision avec n'importe quelle surface solide ou liquide, elles ne rebondissent pas en général de façon élastique mais se condensent à la surface, étant retenues par le champ de forces des atomes de cette surface. Ces molécules peuvent ensuite s'évaporer. Le temps qui s'écoule entre la condensation d'une molécule et son évaporation dépend de l'intensité des forces superficielles. L'adsorption est le résultat direct de cet intervalle de temps. Si les forces superficielles sont relativement intenses, l'évaporation aura lieu à une vitesse négligeable, si bien que la surface du solide sera complètement recouverte d'une couche de molécules. Dans le cas d'une adsorption vraie, cette couche n'aura en général pas plus[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Henri Jean-Marie DOU : ingénieur I.P.S.O.I., docteur ès sciences, directeur de recherche au C.N.R.S., au Centre de recherche rétrospective de Marseille, président de la Société française de bibliométrie appliquée
- Jean-Eugène GERMAIN : professeur de chimie à l'université de Lyon-I-Claude-Bernard
Classification
Médias
Autres références
-
ABZYMES
- Écrit par Joël CHOPINEAU , Encyclopædia Universalis , Alain FRIBOULET , Sabine PILLE et Daniel THOMAS
- 1 038 mots
Le concept d'anticorps catalytique, ou abzyme (contraction d’antibodyet enzyme), fut énoncé dès les années 1940 par Linus Pauling. S’appuyant sur le fait que la réaction chimique de transformation d'une molécule en une autre passe par un état de transition, qui représente...
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 367 mots
- 7 médias
Certaines réactions sont accélérées par la présence de substances étrangères (fréquemment il suffit de très faibles quantités), que l'on trouve inchangées en fin de réaction et que l'on nomme catalyseurs. Lorsqu'en solution le catalyseur est constitué par les ions H+ ou OH... -
ANTIOXYGÈNES
- Écrit par Robert PANICO
- 2 341 mots
- 2 médias
...irradiation ultraviolette : l'absorption d'énergie lumineuse par la substance autoxydable facilite la rupture de la liaison R—H ; — par action de catalyseurs : les peroxydes organiques, en particulier le peroxyde de benzoyle, fournissent, par décomposition thermique, des radicaux... -
ARGILES
- Écrit par Daniel BEAUFORT et Maurice PAGEL
- 2 655 mots
- 7 médias
L' origine de la vie pourrait se trouverdans les propriétés catalytiques des surfaces des minéraux argileux qui auraient favorisé la polymérisation de molécules organiques complexes capables de donner naissance à des structures moléculaires aussi complexes que l'ARN. Les phyllosilicates... - Afficher les 24 références
Voir aussi
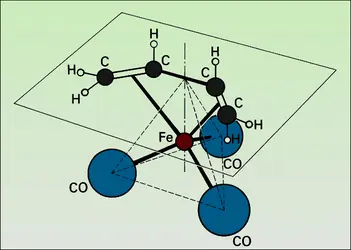
- CARBONYLES MÉTALLIQUES
- CARBÈNES
- POLYMÉRISATION
- ÉTHYLÈNE
- ENZYMES
- HYDROLYSE
- RÉACTIONNELS MÉCANISMES
- BASE, chimie
- CATALYSE ENZYMATIQUE
- CATALYSE HOMOGÈNE
- CATALYSE HÉTÉROGÈNE
- HAMMETT FONCTION DE
- INHIBITEURS, chimie
- FORCE D'UN ACIDE ou D'UNE BASE
- ÉQUILIBRE, chimie
- CATALYSEURS
- HYDROXYLE ou OXHYDRYLE
- VITESSE DE RÉACTION
- CHIMISORPTION
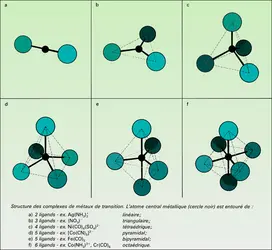
- LIGAND ou COORDINAT, chimie
- FRIEDEL & CRAFTS CATALYSEUR DE
- HYDROGÉNATION
- ACTIVATION, chimie
- CENTRE ACTIF, chimie
- AIRE SPÉCIFIQUE
- AUTO-INHIBITION, chimie
- THERMODYNAMIQUE CHIMIQUE
- PROMOTEUR, chimie
- OXYDATION
- INITIATEUR, chimie
- FRITTAGE
- NUCLÉOPHILES SUBSTITUTIONS
- PLATINE
- SOLIDES PHYSIQUE DES
- SAPONIFICATION
- AMMONIUM QUATERNAIRE
- TRANSITION MÉTAUX DE
- OXYDES
- MONOXYDE DE CARBONE ou OXYDE DE CARBONE (CO)
- RÉACTIVITÉ CHIMIQUE
- ACIDITÉ ÉCHELLE D'
- SÉLECTIVITÉ, chimie
- CATALYSE TRANSFERT DE PHASE PAR