CATALYSE
Catalyse par transfert de phase
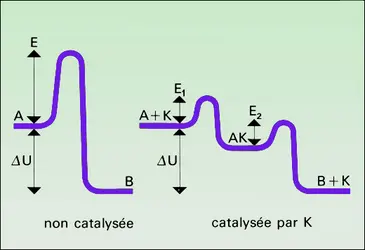
La catalyse par transfert de phase est une méthode de synthèse permettant de réaliser, dans un milieu biphasé (liquide-liquide ou liquide-solide), des réactions de substitution nucléophile impossibles ou difficiles à réaliser en milieu monophasé. Le principe de cette méthode repose sur le fait qu'un réactif nucléophile anionique, formé en milieu aqueux par action d'une base forte sur un acide ou un pseudo-acide, se trouve concentré dans ce milieu auquel le substrat organique n'est pas ou peu miscible et présente une réactivité très atténuée par la solvatation spécifique due au solvant protique. Comme les réactions se produisent à l'interface, une agitation du mélange diphasé (substrat organique lipophile-réactif anionique hydrophile) n'améliore que faiblement la vitesse de réaction. Si, en revanche, on ajoute au milieu réactionnel une quantité catalytique d'un halogénure de cation lipophile (un ammonium ou un phosphonium quaternaire à 12 atomes de carbone ou plus), l'anion nucléophile va former avec le cation onium une paire d'ions lipophiles qui pénètre dans le substrat organique avec lequel elle réagit rapidement, libérant un sel d'onium qui repasse en phase aqueuse et renouvelle son action de transfert, entre les deux phases, du réactif nucléophile.
Par exemple, sous agitation vive et à une température de 80 0C, prenons un mélange de bromure de butyle, phénylacétonitrile, toluène, soude à 40 p. 100 en poids dans de l'eau, triéthyl benzyl ammonium 2 à 4 p. 100 en mole par rapport au phénylacétonitrile. Après 1 heure, il se forme du butyle-2 phénylacétonitrile avec un rendement de 98 p. 100. L'agent basique peut être plus dilué ou plus concentré, voire solide.
Le mécanisme est le suivant : d'abord l'anion se constitue par réaction du phénylacétonitrile avec la soude. Celui-ci est extrait en milieu organique par association avec le cation triéthyl benzyl ammonium (TEBA). Il y a formation de bromure de sodium. L'anion réagit en milieu organique anhydre (la soude jouant le rôle de desséchant) sur le bromure de butyle en formant le butyle-2 phénylacétonitrile correspondant. Un anion bromure est libéré ; celui-ci s'associe avec le cation triéthyl benzyl ammonium, ce qui régénère le catalyseur. Les produits formés restent dans la phase organique. En fin de réaction, les deux phases sont décantées et le catalyseur est éliminé par lavage à l'eau du milieu organique.
Le rôle du solvant est limité. Des contraintes sont cependant liées à son choix, il ne doit pas être soluble dans l'eau et ne doit pas réagir avec un agent basique. Lorsqu'il est nécessaire d'augmenter la température, on peut utiliser des xylènes, ou du chloro- ou dichlorobenzène. Des éthers lourds ont aussi été expérimentés.
Le catalyseur est un ammonium quaternaire qui dans certaines conditions peut se dégrader. C'est le cation qui subira, selon les conditions de réaction, une dégradation. Celle-ci n'est pas due à la réaction d'Hofmann, mais à une réaction d'élimination interne, le cation est attaqué par l'anion. Si celui-ci est « mou », par exemple un anion situé sur un atome de soufre, l'attaque se produira facilement, consistant à éliminer un des groupements alkyle pour conduire à une amine tertiaire, et à un thioéther. Cette dégradation diminue le rendement global de la réaction et peut conduire à la formation de produits secondaires. L'agent alkylant est généralement un halogénure d'alkyle. De ce fait, il peut subir des réactions de dégradation. La plus connue est celle d'une hydrolyse conduisant à un alcool, puis à une élimination en milieu basique, avec formation d'alcène. L'alcool obtenu peut aussi conduire à un éther par la réaction de Williamson. L'hydrolyse a lieu d'autant plus facilement que la soude est diluée. Au cours des réactions[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Henri Jean-Marie DOU : ingénieur I.P.S.O.I., docteur ès sciences, directeur de recherche au C.N.R.S., au Centre de recherche rétrospective de Marseille, président de la Société française de bibliométrie appliquée
- Jean-Eugène GERMAIN : professeur de chimie à l'université de Lyon-I-Claude-Bernard
Classification
Médias
Autres références
-
ABZYMES
- Écrit par Joël CHOPINEAU , Encyclopædia Universalis , Alain FRIBOULET , Sabine PILLE et Daniel THOMAS
- 1 038 mots
Le concept d'anticorps catalytique, ou abzyme (contraction d’antibodyet enzyme), fut énoncé dès les années 1940 par Linus Pauling. S’appuyant sur le fait que la réaction chimique de transformation d'une molécule en une autre passe par un état de transition, qui représente...
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 364 mots
- 7 médias
Certaines réactions sont accélérées par la présence de substances étrangères (fréquemment il suffit de très faibles quantités), que l'on trouve inchangées en fin de réaction et que l'on nomme catalyseurs. Lorsqu'en solution le catalyseur est constitué par les ions H+ ou OH... -
ANTIOXYGÈNES
- Écrit par Robert PANICO
- 2 339 mots
- 2 médias
...irradiation ultraviolette : l'absorption d'énergie lumineuse par la substance autoxydable facilite la rupture de la liaison R—H ; — par action de catalyseurs : les peroxydes organiques, en particulier le peroxyde de benzoyle, fournissent, par décomposition thermique, des radicaux libres... -
ARGILES
- Écrit par Daniel BEAUFORT et Maurice PAGEL
- 2 654 mots
- 7 médias
L' origine de la vie pourrait se trouver dans les propriétés catalytiques des surfaces des minéraux argileux qui auraient favorisé la polymérisation de molécules organiques complexes capables de donner naissance à des structures moléculaires aussi complexes que l'ARN. Les phyllosilicates... - Afficher les 24 références