CÉSIUM
Article modifié le
Le césium est l'élément chimique de numéro atomique 55 et de symbole Cs ; il a été identifié pour la première fois en 1860 par Kirchhoff et Bunsen par analyse spectrale ; deux raies bleues à 456 et 459,7 nm sont à l'origine de son nom (caesium : bleu du ciel). C'est un métal jaune pâle très facilement fusible.
Si l'on excepte le francium, élément 87 qui ne possède pas d'isotope stable, le césium apparaît comme le dernier élément de la famille des métaux alcalins. Sa structure électronique fondamentale est caractérisée par un électron célibataire 6 s qui fait suite à une structure de gaz rare en s2p6 (xénon). De l'effet d'écran dû à cette configuration électronique particulière, il résulte que l'électron de valence n'est que faiblement lié et que cette propriété fondamentale des métaux alcalins est particulièrement marquée dans le cas du césium comme l'indique son faible potentiel d'ionisation : 3,90 eV.
Le césium, comme tous les métaux alcalins, possède dans ses combinaisons le degré d'oxydation + 1, et n'échange que des liaisons ioniques. C'est le plus électropositif de tous les métaux (EOH Cs/Cs+ = − 3,02 V).
État naturel et préparation
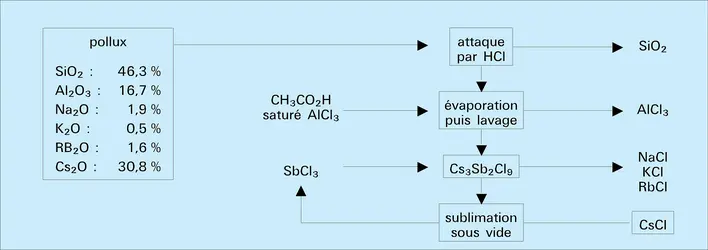
Le césium n'entre que pour un très faible pourcentage dans la composition de l'écorce terrestre (0,0007 p. 100). Il accompagne généralement, en très petite quantité, les autres alcalins dans leurs minerais (lépidolite). Il existe toutefois aux États-Unis, et en Suède un minerai très riche, appelé pollux ou pollucite, silicoaluminate de césium titrant jusqu'à 36 p. 100 en Cs2O et ne contenant que des traces de potassium et de rubidium.
L'extraction du césium à partir d'un minerai complexe (lépidolite), contenant les autres alcalins, constitue l'une des préparations les plus longues et les plus délicates de la chimie minérale. La séparation est effectuée par cristallisation fractionnée de sels dont la solubilité diminue fortement du sodium au césium : aluns (Al2(SO4)3, M2SO4, 24H2O) puis chlorures complexes (M3Sb2Cl9 ou M2PtCl2).
Le chlorure CsCl constitue le produit commercial le plus courant et le plus pur ; il est facilement réduit par le calcium en césium métallique, en opérant sous vide vers 700 0C. Le césium est purifié par distillation fractionnée sous vide moléculaire et conservé en ampoule scellée.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Roger NASLAIN : docteur ès sciences, ingénieur chimiste, professeur à l'université de Bordeaux-I
Classification
Médias
Autres références
-
DIAGRAPHIES, géophysique
- Écrit par Oberto SERRA
- 6 082 mots
- 7 médias
...précédente, mais on soumet cette fois les formations à un bombardement continu de rayons gamma d'énergie égale à 662 kiloélectronvolts émis par une source de césium137Cs. Ces rayons gamma perdent de l'énergie par collision avec les électrons (effet Compton). Un détecteur à scintillation situé à une... -
MÉTAUX - Métaux alcalins
- Écrit par Jean PERROTEY
- 3 023 mots
- 5 médias
-
POLLUTION
- Écrit par François RAMADE
- 20 870 mots
- 16 médias
...d'irradier l'organisme qu'ils contaminent pendant une durée prolongée. Tel est par exemple le cas du strontium 90 (période de 28 ans), qui se fixe dans les os car il est chimiquement voisin du calcium, ou du césium 137 (analogue du potassium), de période de trente-deux ans, qui se fixe dans les muscles. -
SOLS - Dégradation des sols
- Écrit par Mireille DOSSO
- 4 914 mots
- 10 médias
...au développement durable (C.G.D.D.) du ministère de l'Écologie, du Développement durable, des Transports et du Logement, publiées en 2010, le césium 137 présent dans l'environnement a deux origines principales : les retombées des essais atmosphériques d'armes nucléaires effectués entre 1945...
Voir aussi